
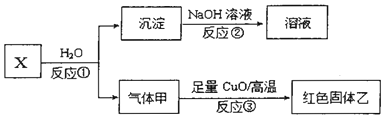
 写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.
写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.分析 气体甲是天然气的主要成分,则甲为CH4,X是由上述四种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,且X与水反应得到甲烷与沉淀,应是金属碳化物与水反应,可推知X为Al4C3,反应得到的沉淀为氢氧化铝,甲烷与CuO反应得到红色固体单质乙为Cu,生成沉淀为Al(OH)3,可与氢氧化钠溶液反应生成NaAlO2,C形成的双原子阴离子为O22-,C为O元素,以此解答该题.
解答 解:(1)气体甲为CH4,为共价化合物,电子式为 ,反应①为碳化铝的水解反应,化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4,
,反应①为碳化铝的水解反应,化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4,
故答案为: ; Al4C3+12H2O=4Al(OH)3+3CH4;
; Al4C3+12H2O=4Al(OH)3+3CH4;
(2)高温下CuO与甲烷发生氧化还原反应,反应的化学方程式为CH4+4CuO$\frac{\underline{\;高温\;}}{\;}$4Cu+CO2+2H2O,故答案为:CH4+4CuO$\frac{\underline{\;高温\;}}{\;}$4Cu+CO2+2H2O;
(3)红色物质如为铜,加入稀硫酸不反应,无明显现象,如含有Cu2O,加入稀硫酸发生Cu2O+2H+═Cu+Cu2++H2O,生成Cu2+,溶液变蓝色,则可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O,
故答案为:取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O.
点评 本题考查考查无机物的推断,为高频考点,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质,难度不大,注意把握提给信息以及物质的性质.


科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g) CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
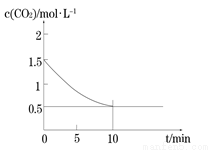
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时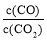 增大的是_________(填序号)。
增大的是_________(填序号)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
下列化合物中属于共价化合物的是
A.NaCl B.NaOH C.CH4 D.(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入CH4的电极为负极 | |
| B. | 负极发生氧化反应 | |
| C. | 该电池使用一段时间后无需补充KOH | |
| D. | 燃料电池工作时,溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障,但低空的臭氧浓度过大,会给生物造成伤害 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,还有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL 0.2 mol•L-1 的 NaCl 溶液 | |
| B. | 100 mL 0.1 mol•L-1 的 NaCl 溶液 | |
| C. | 25 mL 0.2 mol•L-1 的 Na2SO4 溶液 | |
| D. | 10 mL 0.5mol•L-1 的 Na2CO3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
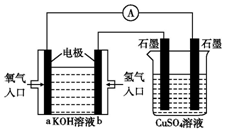 可用碱性氢氧燃料电池组装如图所示的装置:
可用碱性氢氧燃料电池组装如图所示的装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有的分子数为1 NA | |
| B. | 常温常压下,16g O2含有的原子数为1 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水阴极产生氢气而得不到钠 | |
| B. | 铝制器皿不宜盛放酸性食物 | |
| C. | 铁制容器盛放和运输浓硫酸 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com