
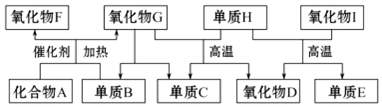
分析 A是气体,它的水溶液呈碱性,则A应为NH3,与单质B在催化剂条件下反应生成两种氧化物,则B为O2;
氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒,则F为NO、D为CO,G为H2O;
结合转化关系可知C为H2、H为C,单质E可作半导体材料,应为Si,则I为SiO2,
根据分析可知:A应为NH3、B为O2、C为H2、D为CO、E为Si、F为NO、G为H2O、H为C、I为SiO2,
结合对应物质的性质以及题目要求可解答该题.
解答 解:(1)由以上分析可知A为NH3,故答案为:NH3;
(2)H为C、I为SiO2,单质C和氧化物SiO2在高温下反应生成硅和一氧化碳,反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)F为NO、B为O2,将2.24L氧化物F和1.68L单质B的物质的量之比为2.24:1.68=4:3,通入水中发生反应:4NO+3O2+2H2O=4HNO3,n(HNO3)=n(NO)=0.1mol,c(HNO3)=0.1mol/L,则溶液的pH=1;故答案为:1.
点评 本题考查无机物的推断,题目难度中等,为高频考点,侧重考查学生的分析、分析能力及综合应用所学知识能力,注意把握物质的性质以及转化关系,为解答该题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )
利用某有机物之间的转换可以贮存太阳能,如原降冰片二烯(NBD)经太阳光照可转化成四环烷(Q),其反应式可表示为:△H=+88.62kJ/mol下列有关说法不正确的是( )| A. | 物质NBD比Q稳定 | |
| B. | NBD和Q互为同分异构体 | |
| C. | 物质NBD和Q的核磁共振氢谱图都有3个峰,但峰面积不同 | |
| D. | 一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:1 | |
| C. | 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 | |
| D. | 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、液态氧、碘酒 NaCl、酒精 | |
| B. | 生石灰、白磷、熟石灰 熔融NaCl、BaSO4 | |
| C. | 干冰、铁、氯化氢 铜、二氧化硫 | |
| D. | 空气、氮气、胆矾 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t 1 | t 2 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应与离子方程式 | 评价 |
| A | 将铜屑加入含Fe3+溶液中:Fe3++Cu═Fe2++Cu2- | 正确 |
| B | Na2O2与H2O反应:Na2O2+H2O═2Na ++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | NaOH溶液与氧化铝反应:Al2O3+2OH-═2AlO2-+H2O | 错误,产物应该是(OH)3 |
| D | 向FeCl3溶液中滴加足量氨水:Fe3++3OH-═Fe(OH)3↓ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪经) | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com