
20 ℃时H2S饱和溶液1 L,其浓度为0.1 mol·L-1,已知其电离方程式为H2S H++HS-,HS-
H++HS-,HS- H++S2-,若要使该溶液H+及S2-浓度都减小,可采取的措施是
H++S2-,若要使该溶液H+及S2-浓度都减小,可采取的措施是
A.通入适量的HCl B.加入适量的NaOH固体
C.通入适量的SO2 D.加入适量的CuSO4固体
C
【解析】
试题分析:A、溶液已经饱和,再通入氯化氢气体抑制氢硫酸的电离,但氯化氢气体溶于水得到强酸,所以氢离子浓度增大,硫离子浓度减小,所以不符合,故A错误;B、氢硫酸和氢氧化钠反应生成硫化钠和水,反应方程式为:H2S+2NaOH=Na2S+H2O,所以加入氢氧化钠后促进氢硫酸的电离,使硫离子浓度增大,氢离子浓度减小,所以B不符合,故B错误;C、通入适量的SO2抑制水的电离,但导致溶液中氢离子浓度和硫离子浓度都减小,所以符合,故C正确;D、氢硫酸和硫酸铜的反应方程式为:H2S+CuSO4=CuS↓+H2SO4,弱酸变成强酸溶液,溶液的PH值减小,硫离子和铜离子生成硫化铜沉淀导致硫离子浓度降低,所以D不符合,故D不正确.
考点:弱电解质电离的影响因素


科目:高中化学 来源:2015届河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C1,C1和C互为同分异构体。则有机物A的可能结构有
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:填空题
在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,理由是:
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
关于下列过程熵变的判断不正确的是( )
A.溶解少量食盐于水中,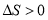
B.纯碳和氧气反应生成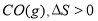
C.H2O(g)变成液态水,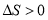
D.CaCO3(s)加热分解为CaO和CO2(g),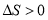
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
鉴别CH3OCH3和CH3CH2OH可采用化学方法和物理方法,下列方法不能对二者进行鉴别的是
A.利用金属钠或金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核子共振氢谱
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
对可逆反应4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减小,平衡正向移动
D.化学反应速率关系是:2v正(NH3)= 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省教学协作体高二上学期期末化学试卷(解析版) 题型:填空题
下图中A—F均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D 为金属单质。(反应过程中水及其他产物已略去)

(1)C是 ,J是 (填化学式)。
(2)写出C与NaOH反应生成F的化学方程式
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学反应方程式 :
查看答案和解析>>
科目:高中化学 来源:2015届江苏省教学协作体高二上学期期末化学试卷(解析版) 题型:选择题
下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.金属的冶炼过程通常是把金属阳离子氧化成单质的过程
C.回收废旧金属既可以治理污染,又可以缓解资源短缺
D.工业上电解氯化镁获得金属镁
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二上学期期末考试化学试卷(选修)(解析版) 题型:选择题
下列实验装置图合理的是
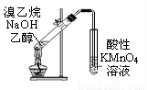
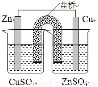
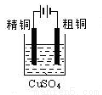
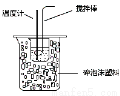
① ② ③ ④
A.装置①可用于证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
B.装置②能构成锌铜原电池
C.装置③可用于粗铜的电解精炼
D.装置④可用于在实验室测定中和反应的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com