
X、Y、Z、W均为短周期主族元素,右图为周期表的一部分。W原子的最外层电子数是其电子层数的2倍。下列说法正确的是
| X |
| Y |
Z |
| W |
|
A.通常情况下,X元素只存在两种氧化物
B.Y元素气态氢化物的还原性最强
C.X元素的非金属性比Y元素非金属性强
D.W的最高价氧化物对应水化物的酸性比Z的强
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:实验题
(14分)二氯化锡是一种重要的电镀原料,又称氯化亚锡。分子式为SnCl2,其沸点为623℃,在水溶液中以SnCl2·2H2O的形式析出。锡的另一种氯化物SnCl4的沸点为114℃。某锡花中(主要成分为锡)含有杂质钡、锑、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如下:
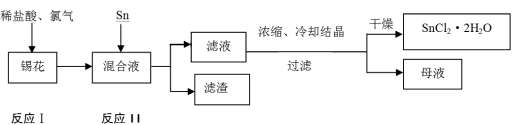
(1)滤渣成分为 (用化学式表示)。
(2)经过氯化后的锡主要以SnCl4的形式存在混合液中。写出锡与SnCl4反应的化学方程式 。
(3)反应Ⅰ进行反应时,加热反应器使反应液温度升高至600C,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80℃~90℃之间,不宜过高。请解释
①温度不宜过高的原因是 ;
②开始通入氯气时,气体流量不宜过大,随反应的进行逐渐加大氯气的通入量,此操作的目的是 。
(4)母液中含有的离子有H+、OH-、 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
A.分别升高温度,两种溶液的pH均减小
B.相同温度下两种溶液的pH:Na2CO3> NaHCO3
C.分别加入少量NaOH,两溶液中c(CO32-)均增大
D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:实验题
(16分) 硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
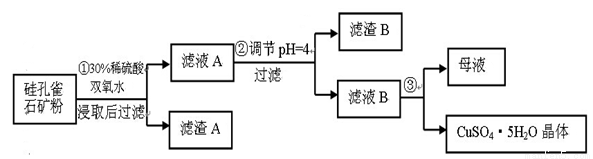
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A. CuO B.Fe2O3 C.Al2O3 D.Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(4)将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.热水瓶胆中的水垢可以用食醋除去
B.可以用淀粉溶液检验加碘盐中是否含碘元素
C.在蔗糖中加入浓硫酸出现黑色物质,说明浓硫酸具有脱水性
D.做红烧鱼时,常加一些食醋和酒会更香,是因为生成少量的酯
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)碘元素的单质和化合物在现实生产生活中应用广泛。
(1)碘化钾(KI)是常用的还原剂。某研究性学习小组利用碘酸钾(KIO3)测定碘化钾的浓度。在10.00mL的KI溶液中逐滴滴入用硫酸酸化的 KIO3溶液,溶液颜色不再变化后,用Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),消耗0.2000mol·L-1 Na2S2O3溶液30.00mL。
滴定过程发生的离子方程式如下:2S2O32-+I2===S4O62-+2I-;
①写出本实验中碘酸钾和碘化钾反应的化学方程式,并标出电子转移的方向和数目:_______________________________________________________。
②滴定终点判断 ;
③测定的KI溶液浓度是 mol·L-1。
(2)探究酸性KIO3溶液的与KI溶液反应中KIO3浓度和温度对反应速率的影响,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
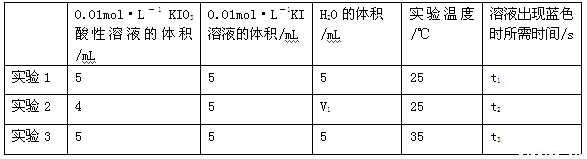
①由小到大比较t1、t2、t3的大小 ;表中V1= mL;
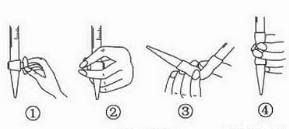
②用Na2S2O3标准溶液滴定生成的I2,滴定前排气泡时,应选用下图中的_________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是
A.LiH的水溶液显中性
B.LiH中的氢离子可以被还原生成氢气
C.LiH是一种强氧化剂
D.LiH中氢离子比锂离子的半径大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com