
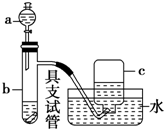
 ČēĶ¼ŹĒÓĆÅØĻõĖį”¢Ķʬ”¢Ė®µČŹŌ¼ĮĢ½¾æÅØ”¢Ļ”ĻõĖįµÄĒæŃõ»ÆŠŌ²¢¹Ū²ģ»¹Ō²śĪļµÄŹµŃé×°ÖĆ£®
ČēĶ¼ŹĒÓĆÅØĻõĖį”¢Ķʬ”¢Ė®µČŹŌ¼ĮĢ½¾æÅØ”¢Ļ”ĻõĖįµÄĒæŃõ»ÆŠŌ²¢¹Ū²ģ»¹Ō²śĪļµÄŹµŃé×°ÖĆ£®·ÖĪö ¢ń£®£Ø1£©ĶÓėÅØĻõĖį·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĻõĖįĶŗĶ¶žŃõ»ÆµŖŗĶĖ®£»
£Ø2£©ŹµŃéÖŠĶČܽāĶ¬Ź±ÓŠŗģ×ŲÉ«ĘųĢå²śÉś£¬ŌņæÉĖµĆ÷ÅØĻõĖį¾ßÓŠĒæŃõ»ÆŠŌ£¬Ńõ»ÆĶµ„ÖŹÉś³ÉĶĄė×Ó£¬¾Ż“Ė“šĢā£»
¢ņ£®£Ø3£©ÉĻŹö·“Ó¦Ķź³Éŗó£¬ĻņŹŌ¹ÜÖŠ¼ÓĖ®½«ÅØĻõĖįĻ”ŹĶ³ÉĻ”ĻõĖį£¬Čē¹ūÄܼĢŠųČܽāĶ£¬ŌņæɽųŅ»²½Ö¤Ć÷Ļ”ĻõĖįŅ²¾ßÓŠĒæŃõ»ÆŠŌ£¬¾Ż“ĖÅŠ¶Ļ½ā“š£»
£Ø4£©ŅĄ¾ŻŅ»Ńõ»ÆµŖĪŖĪŽÉ«£¬¶žŃõ»ÆµŖĪŖŗģ×ŲÉ«£¬Ņ»Ńõ»ÆµŖČŻŅ×±»Ńõ»ÆŃõ»ÆÉś³É¶žŃõ»ÆµŖ£¬¾Ż“ĖÅŠ¶Ļ½ā“š£®
½ā“š ½ā£ŗ¢ń£®£Ø1£©ĶÓėÅØĻõĖį·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĻõĖįĶŗĶ¶žŃõ»ÆµŖŗĶĖ®£¬»Æѧ·½³ĢŹ½£ŗCu+4HNO3£ØÅØ£©ØTCu£ØNO3£©2+2NO2”ü+2H2O£»
¹Ź“š°øĪŖ£ŗCu+4HNO3£ØÅØ£©ØTCu£ØNO3£©2+2NO2”ü+2H2O£»
£Ø2£©ŹµŃéÖŠĶʬČܽā£¬ŹŌ¹ÜÖŠČÜŅŗ±äĄ¶£¬ĒŅÓŠŗģ×ŲÉ«ĘųĢå²śÉś£¬ŌņæÉĖµĆ÷ÅØĻõĖį¾ßÓŠĒæŃõ»ÆŠŌ£¬Ńõ»ÆĶµ„ÖŹÉś³ÉĶĄė×Ó£¬
¹Ź“š°øĪŖ£ŗĶʬČܽā£¬ŹŌ¹ÜÖŠČÜŅŗ±äĄ¶£¬ĒŅÓŠŗģ×ŲÉ«ĘųĢå²śÉś£»
¢ņ£®£Ø3£©ÉĻŹö·“Ó¦Ķź³Éŗó£¬ĻņŹŌ¹ÜÖŠ¼ÓĖ®½«ÅØĻõĖįĻ”ŹĶ³ÉĻ”ĻõĖį£¬Čē¹ūÄܼĢŠųČܽāĶ£¬ŌņæɽųŅ»²½Ö¤Ć÷Ļ”ĻõĖįŅ²¾ßÓŠĒæŃõ»ÆŠŌ£¬
¹Ź“š°øĪŖ£ŗĻņŹŌ¹ÜÖŠ¼ÓĖ®½«ÅØĻõĖįĻ”ŹĶ£»
£Ø4£©ČōbÉś³ÉµÄĘųĢåĪŖŗģ×ŲÉ«£¬ĖµĆ÷ĘųĢåĪŖ¶žŃõ»ÆµŖ£¬ČōbÉś³ÉµÄĘųĢåĪŖĪŽÉ«£¬½Ó“„æÕĘųŗó±äĪŖŗģ×ŲÉ«£¬ĖµĆ÷Éś³ÉĘųĢåĪŖŅ»Ńõ»ÆµŖ£¬¹ŹŃ”C£»
¹Ź“š°øĪŖ£ŗC£®
µćĘĄ ±¾Ģāæ¼²éĮĖĻõĖįµÄŠŌÖŹ£¬Ć÷Č·ĻõĖįŃõ»ÆŠŌÓėÅضČÖ®¼äµÄ¹ŲĻµŹĒ½āĢā¹Ų¼ü£¬×¢Ņā½āÓŠ¹ŲĻõĖį·“Ó¦µÄ¼ĘĖćĢāŹ±£¬¶ŌµŖŌ×ÓŹŲŗćµÄÓ¦ÓĆ£¬ĢāÄæÄŃ¶Č²»“ó£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé²½Öč | Ō¤ĘŚĻÖĻóŗĶ½įĀŪ |
| ²½Öč1£ŗȔɣĮæĪüŹÕŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓĻ”ĮņĖįĖį»Æ£¬Č»ŗóŌŁµĪČė¼øµĪĘ·ŗģČÜŅŗ£» | ĻÖĻó£ŗĘ·ŗģ²»ĶŹÉ« ½įĀŪ£ŗ¼ŁÉč1²»³ÉĮ¢£» |
| ²½Öč2£ŗĮķȔɣĮæĪüŹÕŅŗÓŚŹŌ¹ÜÖŠ£¬ µĪČė¼øµĪKSCNČÜŅŗ£® | ĻÖĻó£ŗČÜŅŗ±äŗģ ½įĀŪ£ŗ¼ŁÉč2³ÉĮ¢£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1molCuŗĶ×ćĮæČČÅØĮņĖį·“Ó¦æÉÉś³ÉSO3·Ö×ÓŹżĪŖ0.1NA | |
| B£® | ±ź×¼×“æöĻĀ£¬5.6LCO2Óė×ćĮæNa2O2·“Ó¦×ŖŅʵĵē×ÓŹżĪŖ0.5NA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬6.0g SiO2ŗ¬ÓŠµÄSiO2·Ö×ÓŹżĪŖ0.1NA | |
| D£® | ¹¤ŅµÉĻ½«°±ĘųÓėŃõĘųŌŚ“߻ƼĮ×÷ÓĆĻĀ·¢ÉśŃõ»Æ·“Ó¦£¬ČōÓŠ±ź×¼×“æöĻĀV L°±ĘųĶźČ«·“Ó¦£¬²¢×ŖŅĘnøöµē×Ó£¬Ōņ°¢·ü¼ÓµĀĀŽ³£ŹżNAæɱķŹ¾ĪŖ£ŗ$\frac{22.4n}{5V}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
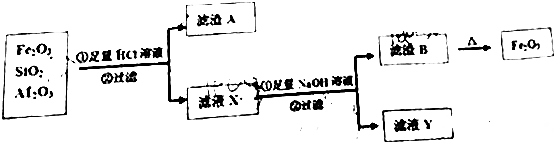
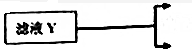
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¾§Ģå¹č | B£® | ¶žŃõ»Æ¹č | C£® | øÖ | D£® | ĀĮ¹čŗĻ½š |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1.0 | B£® | 2.0 | C£® | 13.0 | D£® | 14.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2O”¢CH4”¢HF | B£® | ŗģĮ×”¢Įņ”¢µā | ||
| C£® | CO2”¢SO2”¢NO2 | D£® | H2SO4”¢CH3CH2OH”¢HCHO |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com