
| A. |  | B. |  | C. |  | D. |  |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
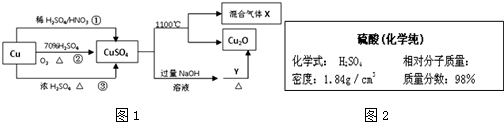
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.84 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 加入催化剂,有利于合成氨的反应 | |
| C. | 将混合气体中的氨液化,有利于合成氨的反应 | |
| D. | 工业生产硫酸的过程中,使用过量的空气以提高二氧化硫的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
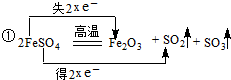 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
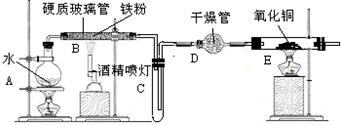
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
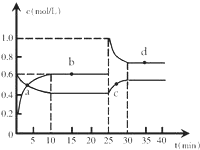 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com