
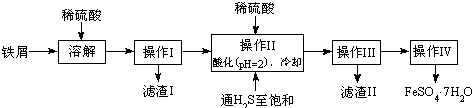
| 25��ʱ | pHֵ |
| ����H2S��Һ | 3.9 |
| SnS������ȫ | 1.6 |
| FeS��ʼ���� | 3.0 |
| FeS������ȫ | 5.5 |
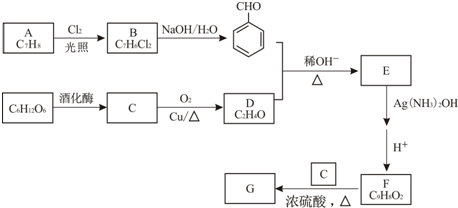
���� ��м���������������������ʣ��������ܽ⣬���������������������������˳�ȥ�������Һ�м���ϡ�����ữ����ͨ�����⣬������SnS��������ֹ�������ӱ����������˷��룬�õ���ҺΪ������������������Ũ������ȴ�ᾧ�����˵Ȳ����ɵõ�FeSO4•7H2O��
��1��ͨ�����������ͣ���ȥ��������Sn2+��������ǿ��ԭ������ԭ�����ӣ���ֹ�������ӱ���������H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5������������Һ���������ữ��pH=2��Ŀ�ģ�ʹSn2+��ȫ�������������Ӳ�������
��2������IV�õ����̷�������������ˮϴ�ӣ�ϴȥ�������ʣ��¶Ƚ����̷��ܽ�Ƚ��ͣ������̷��������ʧ��
��3��ClO-��Fe2+����ΪFeO42-����������ԭΪCl-��
��4������Ksp[Fe��OH��3]=c��Fe3+��•c3��OH-��=4��10-38���㣻
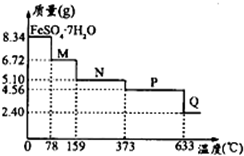
��5����8.34g FeS04•7H2O��Ʒ���ʵ���=$\frac{8.34g}{278g/mol}$=0.03mol������m��H2O��=0.03mol��7��18g/mol=3.78g���羧��ȫ��ʧȥ�ᾧˮ�����������ӦΪ8.34g-3.78g=4.56g����֪�ڼ��ȵ�373��֮ǰ������ʧȥ���ֽᾧˮ������100��ʱʧȥ�ᾧˮ����������ȷ��M�нᾧˮ����������ȷ��M�Ļ�ѧʽ��
�ھ�����ˮ����֮���γ���������Ӽ���������ˮ�������������ӿ����γ���λ����
��� �⣺��м���������������������ʣ��������ܽ⣬���������������������������˳�ȥ�������Һ�м���ϡ�����ữ����ͨ�����⣬������SnS��������ֹ�������ӱ����������˷��룬�õ���ҺΪ������������������Ũ������ȴ�ᾧ�����˵Ȳ����ɵõ�FeSO4•7H2O��
��1����H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5������������Һ���������ữ��pH=2��Ŀ���ǣ�����ҺPH=2ʱ��Sn2+��ȫ�������������Ӳ�������ͨ�����������͵�Ŀ���ǣ��������ǿ��ԭ�ԣ����Է�ֹ�������ӱ�������
�ʴ�Ϊ����ȥSn2+����ֹFe2+����������ֹFe2+������
ʹSn2+��ȫ���SnS��������Fe2+����������ֹFe2+��������
��2���̷���������������ʣ���������ˮ����ϴȥ����������������ӣ��¶Ƚ����̷��ܽ�Ƚ��ͣ������̷����ܽ�µ���ʧ��
�ʴ�Ϊ��ϴȥ����������������ʣ����;�����ܽ�ȣ������ܽ��FeSO4•7H2O����ģ�
��3��ClO-��Fe2+����ΪFeO42-����������ԭΪCl-����Ӧ���ӷ���ʽΪ��2ClO-+Fe2++4OH-=FeO42-+2Cl-+2H2O��
�ʴ�Ϊ��2ClO-+Fe2++4OH-=FeO42-+2Cl-+2H2O��
��4����ҺpH=4ʱ����Һ��c��OH-��=10-10mol/L�����Ksp[Fe��OH��3]=c��Fe3+��•c3��OH-��=4��10-38����֪��Һ��c��Fe3+��=4.0��10-8mol/L��
�ʴ�Ϊ��4.0��10-8��
��5����8.34g FeS04•7H2O��Ʒ���ʵ���=$\frac{8.34g}{278g/mol}$=0.03mol������m��H2O��=0.03mol��7��18g/mol=3.78g���羧��ȫ��ʧȥ�ᾧˮ�����������ӦΪ8.34g-3.78g=4.56g����֪�ڼ��ȵ�373��֮ǰ������ʧȥ���ֽᾧˮ���¶�Ϊ78��ʱ����������Ϊ6.72g������m��FeSO4��=0.03mol��152g/mol=4.56g��m��H2O��=6.72g-4.56g=2.16g��n��H2O��=$\frac{2.16g}{18g/mol}$=0.12mol����n��H2O����n��FeSO4��=0.12mol��0.03mol=4��1����100��ʱ��M�Ļ�ѧʽΪFeSO4•4H2O��
�ʴ�Ϊ��FeSO4•4H2O��
�ھ�����ˮ����֮���γ���������Ӽ���������ˮ�������������ӿ����γ���λ������������3�ֲ�ͬ�������ˮ���ӣ�
�ʴ�Ϊ��3��
���� ���⿼�������Ʊ��������̣��漰���ʵķ����ᴿ����ԭ���ķ������ۡ��������ơ�������ɼ���ȣ�ע�����Ŀ��Ϣ���ã���������Ԫ�ػ�����֪ʶ������������ѧ������������ʵ���������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ⱥ��ʳ��ˮʱ������ҺpH��7��Ϊ13����·��ת�Ƶĵ�����Ϊ0.1NA | |
| B�� | ��״���£�35.5 g �������������ȵ�����ַ�Ӧ�õ��ĵ�����һ��ΪNA | |
| C�� | ��״���£�2.24 L HF�к��е�ԭ����Ϊ0.2NA | |
| D�� | ���ܱ������м���0.5 moL N2��1.5 moL H2����ַ�Ӧ�������е�N-H����Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
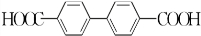
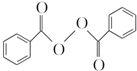 ����ȥ�����������������Ŀǰ�ѱ����ã��ϳɹ�����������������ͼ��ͼ��
����ȥ�����������������Ŀǰ�ѱ����ã��ϳɹ�����������������ͼ��ͼ��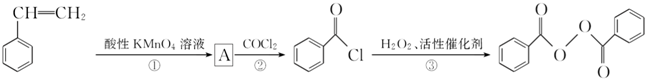
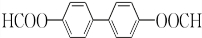
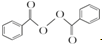 +2H2O��2
+2H2O��2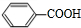 +H2O2��
+H2O2��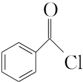 ������ˮ��Ӧ���ɱ����ᣬͬ��Ҳ�����Ҵ���Ӧ��д�������Ҵ���Ӧ���ɵ��л���������Ʊ�����������
������ˮ��Ӧ���ɱ����ᣬͬ��Ҳ�����Ҵ���Ӧ��д�������Ҵ���Ӧ���ɵ��л���������Ʊ�����������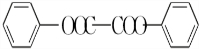 ����
���� ��
�� ����
�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
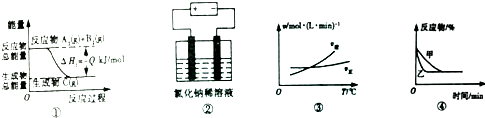
| A�� | ͼ�ٱ�ʾ���淴ӦA2��g��+B2��g��?C��g���ġ�H1����0 | |
| B�� | ͼ���ǵ���Ȼ���ϡ��Һ�ĵ��أ�������������������������֮��һ��Ϊ1��1 | |
| C�� | ͼ�۱�ʾ���淴ӦA2��g��+3B2��g��?2AB3��g���ġ�HС��0 | |
| D�� | ͼ�ܱ�ʾѹǿ�Կ��淴Ӧ2A��g��+2B��g��?3C��g��+D��s����Ӱ�죬�����߶�Ӧ��ѹǿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | MgCl2 �����ʵ���Ũ��Ϊ0.5mol•L-1 | |
| B�� | Cl-�ĸ���Ϊ3.01��1023 | |
| C�� | Mg2+�����ʵ���Ϊ2mol | |
| D�� | Cl-�����ʵ���Ũ��Ϊ2mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�Ƿ��Ȼ������ȱ��뿴������ͷ�Ӧ�������е�����������Դ�С | |
| B�� | ��ɫֲ����й������ʱ����̫����ת��Ϊ��ѧ�ܴ������� | |
| C�� | ���ȷ�Ӧ��Ҫ���Ȳ��ܽ��� | |
| D�� | ���ʵĻ�ѧ�ܿ�����һ��������ת��Ϊ���ܡ�����Ϊ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl- | B�� | Br- | C�� | MnO4- | D�� | H2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
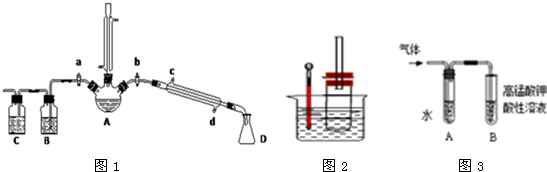
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
��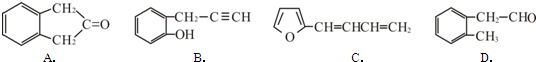
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com