
 对叔丁基苯酚
对叔丁基苯酚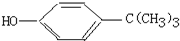 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51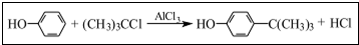 .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
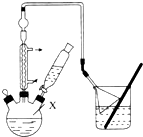
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.分析 (1)根据仪器的构造特点,可知仪器X是三颈烧瓶;
(2)向A中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放,这说明苯环上的氢原子被取代,同时生成氯化氢,即产生的气体是氯化氢;
该反应为放热反应,反应过于激烈,放出大量热,因此导致体系温度升高,从而使得叔丁基氯挥发;
(3)氯化氢极易溶于水,则图中倒扣漏斗的作用是防止倒吸;
苯酚不溶于水,易溶在酒精中,若苯酚溶液沾到皮肤上可用酒精洗涤;
(4)苯酚的熔点较低且有毒,稍微加热固体即可转化为液体;
(5)仪器带有活塞或瓶塞的装置,使用前需要检查是否漏水;
(6)根据苯酚质量计算理论上可以生成对叔丁基苯酚的质量,进而计算产率.
解答 解:(1)根据仪器的构造特点可判断,仪器X是三颈烧瓶,故答案为:三颈烧瓶;
(2)向A中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放,这说明苯环上的氢原子被取代,同时生成氯化氢,即产生的气体是氯化氢,因此出步骤2中发生主要反应的化学方程式为 .该反应为放热反应,反应过于激烈,放出大量热,因此导致体系温度升高,从而使得叔丁基氯挥发,因此导致产率降低,
.该反应为放热反应,反应过于激烈,放出大量热,因此导致体系温度升高,从而使得叔丁基氯挥发,因此导致产率降低,
故答案为: ;由于叔丁基氯挥发导致产率降低;
;由于叔丁基氯挥发导致产率降低;
(3)氯化氢极易溶于水,则图中倒扣漏斗的作用是防止倒吸.苯酚不溶于水,易溶在酒精中,若苯酚溶液沾到皮肤上可用酒精洗涤,
故答案为:防止倒吸;酒精;
(4)苯酚的熔点较低且有毒,稍微加热固体即可转化为液体,在通风橱中中对试剂瓶温水加热,
故答案为:在通风橱中中对试剂瓶温水加热;
(5)容量瓶、滴定管、分液漏斗在使用前均需要查漏,故选:BCD;
(6)1.6g苯酚理论上可以生成对叔丁基苯酚的质量是1.6g÷94g/mol×150g/mol=2.55g,所以对叔丁基苯酚的产率为$\frac{1.8g}{2.55g}$×100%=70.5%,
故答案为:70.5%.
点评 本题考查有机物制备实验,涉及化学仪器识别与使用、对装置与原理的分析与评价、实验安全、物质的分离与提纯等,题目综合性较强,是对学生综合能力考查,有利于培养学生分析能力、实验能力、知识迁移应用能力.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化[2SO2(g)+O2(g)?2SO3 (g)],不采用高压是因为压强对SO2转化率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由Na+与O22-(填写离子符号)构成的.
,它是由Na+与O22-(填写离子符号)构成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)=n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
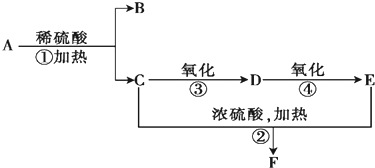
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
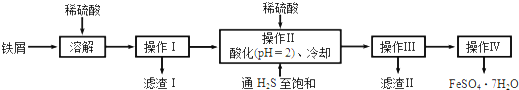
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “哑泉”之毒是由于水中的Cu2+使人体中的蛋白质分解 | |
| B. | “哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性 | |
| C. | “哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性 | |
| D. | “安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若质量相等,则质子数一定相等 | B. | 若原子数相等,则中子数一定相等 | ||
| C. | 若分子数相等,则体积一定相等 | D. | 若密度相等,则体积一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com