
����Ŀ��ҩ��Targretin(F)�����������Ƥ��T��ϸ���ܰ�������ϳ�·������ͼ��ʾ��
(1)��Ӧ�ٵķ�Ӧ������______________��
(2)��Ӧ�ڵĻ�ѧ����ʽ��__________________________________________��
(3)C�ĺ˴Ź�������ͼ����______________���塣
(4)��Ӧ�۵Ļ�ѧ����ʽ��__________________________________________��
(5)F�ķ���ʽ��C24H28O2. F�к��еĹ����ţ�__________________________��
(6)д��������������A������ͬ���칹��Ľṹ��ʽ�������ǡ�O��O����![]() �ṹ����_______________________________________________________________��
�ṹ����_______________________________________________________________��
a�������ϵ�һ�ȴ��������� b�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
(7)��֪��![]() ����2-��������ϩΪԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�
����2-��������ϩΪԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�![]() �ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������________��
�ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������________��
���𰸡� ������Ӧ ![]() 2
2  ̼̼˫�����Ȼ�
̼̼˫�����Ȼ� 

���������������Զ��ױ������Ը����������Ϊ�Ա������ᣬ�Ա���������״�����������Ӧ���ɣ�B�� ��������Ϣiii��֪��B��SOCl2��Ӧ����
��������Ϣiii��֪��B��SOCl2��Ӧ���� ��
�� ���巢��1,4�ӳ�����(CH3)2CBr-CH=CH-BrC(CH3)2,���л��������������ӳ�����(CH3)2CBr-CH2CH2-BrC(CH3)2,������Ϣii��֪��(CH3)2CBr-CH2CH2-BrC(CH3)2��
���巢��1,4�ӳ�����(CH3)2CBr-CH=CH-BrC(CH3)2,���л��������������ӳ�����(CH3)2CBr-CH2CH2-BrC(CH3)2,������Ϣii��֪��(CH3)2CBr-CH2CH2-BrC(CH3)2��![]() ����ȡ����Ӧ����
����ȡ����Ӧ���� ��Ȼ�������Ϣi��֪���л���
��Ȼ�������Ϣi��֪���л��� ��
�� ����ȡ����Ӧ����
����ȡ����Ӧ���� ��
�� �����������·���ˮ������
�����������·���ˮ������ ��F�����ݴ˽��н��⡣
��F�����ݴ˽��н��⡣
��⣺(1) �Զ��ױ������Ը����������Ϊ�Ա������ᣬ��Ӧ�ٵķ�Ӧ������������Ӧ����ȷ�𰸣�������Ӧ��
(2) �Ա���������״�����������Ӧ���ɣ�B�� ����Ӧ�ڵĻ�ѧ����ʽ��
����Ӧ�ڵĻ�ѧ����ʽ��![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
(3)�������Ϸ�����֪���л���C�Ľṹ��ʽΪ(CH3)2CBr-CH=CH-BrC(CH3)2,��̼̼˫��Ϊ�Գ�����з�����֪���˴Ź�������ͼ����2���壻��ȷ�𰸣�2��
(4) ������Ϣii��֪��(CH3)2CBr-CH2CH2-BrC(CH3)2��![]() ����ȡ����Ӧ����
����ȡ����Ӧ���� ����Ӧ�۵Ļ�ѧ����ʽ��
����Ӧ�۵Ļ�ѧ����ʽ�� ����ȷ�𰸣�
����ȷ�𰸣� ��
��
(5)���Ϸ�����֪���л���F�ķ���ʽ��C24H28O2.���ṹ��ʽΪ �����еĹ����ţ�̼̼˫�����Ȼ�����ȷ�𰸣�̼̼˫�����Ȼ���
�����еĹ����ţ�̼̼˫�����Ȼ�����ȷ�𰸣�̼̼˫�����Ȼ���
(6)����AΪ�Ա������ᣬͬ���칹������a�������ϵ�һ�ȴ��������֣�����������ȡ������b�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ���ṹ�к���HCOO-ȡ����������ṹ����:  ����ȷ����
����ȷ���� ��
��
(7) ��ϩ����ӳ�����BrCH2CH2Br��BrCH2CH2Br����ȡ������HOCH2CH2OH��HOCH2CH2OH������ΪOHCCHO��������Ϣ![]() ��֪�������������Ľṹ��ʽ��֪��OHCCHO��CH3CHBrCH3��Mg/H2O�����·����ӳɷ�Ӧ����
��֪�������������Ľṹ��ʽ��֪��OHCCHO��CH3CHBrCH3��Mg/H2O�����·����ӳɷ�Ӧ���� �����л����ٷ�����ȥ����
�����л����ٷ�����ȥ����![]() ������ϳ�3�������£�
������ϳ�3�������£� ����ȷ�𰸣�
����ȷ�𰸣� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx����ҪָNO��NO2���Ǵ�����Ҫ��Ⱦ��֮һ����Чȥ�������е�NOx�ǻ�����������Ҫ���⡣
��1����ˮ����NOx������Ȼ�ѧ����ʽ���£�
2NO2��g��+H2O��l��![]() HNO3��aq��+HNO2��aq�� ��H=116.1 kJ��mol1
HNO3��aq��+HNO2��aq�� ��H=116.1 kJ��mol1
3HNO2��aq��![]() HNO3��aq��+2NO��g��+H2O��l�� ��H=75.9 kJ��mol1
HNO3��aq��+2NO��g��+H2O��l�� ��H=75.9 kJ��mol1
��Ӧ3NO2��g��+H2O��l��![]() 2HNO3��aq��+NO��g������H=___________kJ��mol1��
2HNO3��aq��+NO��g������H=___________kJ��mol1��
��2����ϡ��������NOx���õ�HNO3��HNO2�Ļ����Һ�����û����Һ�ɻ�ý�Ũ�����ᡣд�����ʱ�����ĵ缫��Ӧʽ��____________________________________��
��3��������(NH2)2COˮ��Һ����NOx�����չ����д���HNO2��(NH2)2CO����N2��CO2�ķ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��____________________________________��
��4�������������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2��
��NH3��NO2����N2�ķ�Ӧ�У�������1 mol N2ʱ��ת�Ƶĵ�����Ϊ__________mol��
�ڽ�һ��������O2��NH3��NOx�Ļ�����壬����ͨ��װ�д���M�ķ�Ӧ���з�Ӧ��װ�ü���20ͼ1����

��Ӧ��ͬʱ��NOx��ȥ�����淴Ӧ�¶ȵı仯��������20ͼ2��ʾ����50��250 �淶Χ�������¶ȵ����ߣ�NOx��ȥ������Ѹ��������������������Ҫԭ����____________________________������Ӧ�¶ȸ���380 ��ʱ��NOx��ȥ����Ѹ���½���ԭ�������___________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ĿҪ���û�ѧ���Իش����⡣
��I����ȥ���������ڵ�����ͨ�����õ�ʵ�鷽����ʲô���������ں����ϡ�
(1)CH3CH2OH(H2O)_____________________________________________________��
(2)![]() (NaCl)____________________________________________��
(NaCl)____________________________________________��
(3) ![]() (Br2)___________________________________________________��
(Br2)___________________________________________________��
��II��ij�л����ʵ��ʽΪC2H6O���������Dzⶨ����Է������������ⶨ�õ���ͼ1��ʾ������ͼ������ú˴Ź����Ǵ������л���õ���ͼ2��ʾ�ĺ˴Ź�������ͼ��

�Իش��������⣺
(1)���л����������Է�������Ϊ________��
(2)��д�����л�������Ľṹ��ʽ________��
��III���л���E(C3H3Cl3)��һ�ֲ�ǰ���ݼ���ǰ�壬��ϳ�·�����¡�

��֪D�ڷ�Ӧ���������ɵ�E����ṹֻ��һ�ֿ��ܣ�E��������3�ֲ�ͬ���͵���(�����ǿռ��칹)���Իش��������⣺
(1)��������е���Ϣ�Ʋ���A�Ľṹ��ʽΪ______________����A��ͬϵ���У���Է���������С���������Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ____________________________��
(2)д�����з�Ӧ�����ͣ���Ӧ����____________����Ӧ����________��
(3)��������е���Ϣ�Ʋ��л���D��������______________��
(4)��д����Ӧ�۵Ļ�ѧ����ʽ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ������H2A��HA-��A2-����ˮ��Һ��ϵ�У�H2A��HA-��A2- �����и�����ռ�����ʵ�����������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. �ں�H2A��HA-��A2- ����Һ�У���������NaOH���壬����HA-��һ������
B. �������ʵ�����NaHA��Na2A���������ˮ��������Һ������HA-��=����A2-��
C. NaHA��Һ�У�HA-��ˮ����������HA-�ĵ�������
D. �ں�H2A��HA-��A2-����Һ�У���c(H2A)+2c(A2-)+c(OH-)=c(H+)��������H2A��������HA-����һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiCl4�����Ѿ�����Ҫ�ɷ�ΪTiO2���Ʊ��ѣ�Ti������Ҫ�м����Ʊ���TiCl4������ʾ��ͼ���£�
![]()
���ϣ�TiCl4�����������Ȼ��������
������ | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
�е�/�� | 58 | 136 | 181�������� | 316 | 1412 |
�۵�/�� | 69 | 25 | 193 | 304 | 714 |
��TiCl4�е��ܽ��� | ���� | ���� | �� | ���� | |
��1���Ȼ����̣�TiO2��Cl2����ֱ�ӷ�Ӧ����̼����CO��CO2��ʹ��Ӧ���Խ��С�
��֪��TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ��H1=+175.4 kJ��mol-1
2C(s)+O2(g)=2CO(g) ��H2=-220.9 kJ��mol-1
�� ����¯�м�̼�Ȼ�����TiCl4(g)��CO(g)���Ȼ�ѧ����ʽ��____________________��
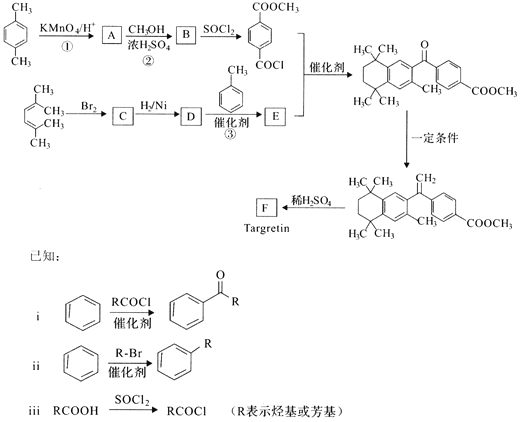
�� �Ȼ�������CO��CO2�����ת����������ͼ�жϣ�CO2����CO��Ӧ�Ħ�H_____0���������������=�������ж����ݣ�_______________��
�� �Ȼ���Ӧ��β���봦�����ŷţ�β���е�HCl��Cl2�����տɵô����ᡢFeCl3��Һ����β��������Һ������__________________________��
�� �Ȼ�������ȴ�����£������˵õ���TiCl4���Һ���������к���_____________��
��2�����ƹ��̣���TiCl4����������ô�TiCl4��ʾ��ͼ���£�
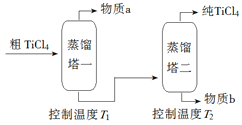
����a��______________��T2Ӧ������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����( )
A. 10mL0.1mol��L-1Na2CO3��Һ��εμӵ�10mL0.1mol��L-1�����У������Һ�и�����Ũ�ȵĴ�С��ϵ��c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B. NH4HCO3��Һ�д��ڣ�C(NH4+)=C(HCO3-)+C(CO32-)+C(H2CO3)
C. �����£����ij��CaSO3��ˮ�γɵ���ҺpHΪ9����֪Ka1(H2SO3)��1.8��10-2��Ka2(H2SO3)��6.0��10-9������SO32-�ĵڶ���ˮ�⣬��Ksp(CaSO3)��3.6��10-10
D. ����������Һ��Ũ����ͬ��pH(NaX)>pH(NaY)����c(X��)��c(OH��)��c(Y��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ZnO��ҽҩ��ʯ���������й㷺����;���о�С����ij��п��(��Ҫ�ɷ�ZnS������FeS��SiO2��MnCO3������)�Ʊ�����п�����ʣ�����������̣�

��ش��������⣺
(1)����1�Ļ�ѧʽΪ_______����дһ�ָ����ʵ���;��_______________��
(2)����X�Ļ�ѧʽΪ______________��
(3)��ת��������Ҫ��Ӧ�����ӷ���ʽΪ___________________________��
(4)��Ksp(ZnCO3)=1.5��10��10����Һ������Ũ�ȡ�1.0��10��5molL��1ʱ����Ϊ�����ӳ�����ȫ������ʹ1Lc(Zn2+)=1.5molL��1��Һ��Zn2+������ȫ�������������Na2CO3��Һ�����ʵ���Ũ������Ϊ_______________________molL��1 (д����ȷ����������Һ���ʱ����仯���Բ���)��
(5)��һϵ�в������������ˡ�ϴ�ӡ�����������õIJ���������______��ϴ�ӳ����IJ���Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij�ؿ�����SO2�Ϳ���������ĺ�����ijͬѧ���������ͼ��ʾ��ʵ��װ�ã�

ע���������ٹ�������������λʱ����ͨ�����������װ��
��1������ʵ��ⶨԭ��Ϊ_________________________________ (�û�ѧ����ʽ��ʾ)��
��2��Ӧ������װ�òⶨ������SO2�Ϳ���������ĺ���������ⶨ��������(��λ:mL��s-1)�⣬����Ҫ�ⶨ����Һ��ɫ��ȥ�����ʱ���___________________________��
��3����֪���ⵥ������ˮ��KI�����������ˮ���ܽ�ȡ�Ϊ��ȷ����100 mL 5.0��10-4mol��L-1�ĵ���Һ����Ҫ����1000 mL 1.0��10-2mol��L-1����Һ����ȡ5.00 mL��Һϡ�ͳ�Ϊ5.0��10-4mol��L-1����Һ��
�ٵ�һ������������ƽ��ȡ___ g �ⵥ�ʼ����ձ��У�ͬʱ���������⻯�ع��壬������ˮ����ʹ֮��ȫ�ܽ⡣
�ڵڶ�����________________��ϴ�ӡ����ݡ�ҡ�ȡ�
�۵��������õڶ���������Һ����5.0��10-4mol��L-1����Һ���˲������У����ձ�������������ͷ�ι����Ҫ�IJ���������________________________��
��4��������SO2�����IJⶨ��
����֪�����ж����������������ŷ�Ũ�Ȳ��ó���0.02mg��L-1����ָ���ĵص�ȡ������200mL��s-1��������ͨ���������ٹ�ͨ�뵽��ͼʵ��װ���У��۲��¼����Һ��ɫ����ʱ��Ϊ500s����õؿ����е�SO2������________ mg��L-1��____________(����ϡ����������ϡ�)�ŷű���
�������ͬѧ�ø÷�������������SO2�ĺ���ʱ������õ���ֵ��ʵ�ʺ����ͣ���ԭ�������________________________________(������Һ���ơ���������ȡ�����ֶ���������д��һ�ֿ���ԭ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
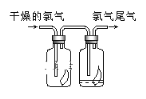
����Ŀ��ij����С������ͼ��ʾ��ʵ��װ��̽�������백��֮��ķ�Ӧ������A��FΪ�����Ͱ����ķ���װ��,DΪ����������������백����Ӧ��װ�á�
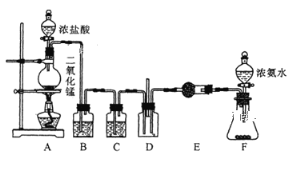
��ش���������:
(1)ʵ�����ö������̺�Ũ���ᷴӦ��ȡ����,д���÷�Ӧ�Ļ�ѧ����ʽ__________
(2)C��E���Ǹ���װ��,����E�и��������װ���Լ���__________
(3)��Ӧ��ʼ��װ��D�г���Ũ��İ��̲��������ڱ�����,�С�������ͨ��ʵ������ù���ijɷ֡�����Э��������ɸ�ʵ��̽����
�����:ȡ������Ʒ������ˮ�ܽ�,��װ����֧�Թ��С�������һ֧�Թ��м���ŨNaOH��Һ,����,��ʪ��ĺ�ɫʯ����ֽ�����Թܿڸ���,��ɫʯ����ֽ����,֤���ù����к���__________����
�����:����һ֧�Թ��м��������ữ����������Һ,��������ɫ����,˵����Һ�к���__________����
(4)����ɫ��ѧ�ĽǶȿ��Ǹ�װ������һ���Բ�����֮��,��������Ľ��������__________
(5)��ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ�г�ʪ��ɫ�����Ĺ��ƿ���ɹ۲쵽��������___________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com