解:(1)B装置为块状不溶于水的固体和液体反应制取气体的装置,并不用加热,中学化学中常见的有:H
2、CO
2、H
2S 等,故答案为:H
2、CO
2、H
2S 等;
(2)实验室制得的氯气中有杂质气体水蒸气和氯化氢气体,要进行干燥的氯气不具备漂白性的验证试验,再进行实验Ⅰ才能得到结论;氯化氢气体溶于水形成盐酸,盐酸也能和碳酸氢钠反应产生二氧化碳气体,不一定是氯气与水反应的产物的酸性,故答案为:不合理,没有事先证明干燥的氯气无漂白性;不合理; 制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(3)验证Cl
-和Br
-的还原性强弱可根据反应Cl
2+2Br
-=2Cl
-+Br
2设计实验,在A装置中制备氯气,生成的气体通入到装有溴化钠溶液的C中,如烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴,
故答案为:在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液;烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴;
(4)浓硝酸具有强氧化性,与铜反应生成二氧化氮气体,反应的化学方程式为Cu+4HNO
3(浓)═Cu(NO
3)
2+2NO
2↑+2H
2O,
故答案为:Cu+4HNO
3(浓)═Cu(NO
3)
2+2NO
2↑+2H
2O;
(5)浓硝酸与铜反应生成的二氧化氮收集于试管丁中,装置验证NO
2与水的反应,要先关闭a、b,然后用微热法使试管中气体逸出,NO
2与水接触后即可引发烧杯中的水倒流入试管丁中,
故答案为:a、b;c;双手紧握(或微热)试管丁,使试管中气体逸出,NO
2与水接触后即可引发烧杯中的水倒流入试管丁中;
(6)NO
2和O
2混合气体的试管倒立于水中,发生反应:4NO
2+O
2+2H
2O=4HNO
3 最后剩余气体可能为氧气,也可能是NO气体,设NO
2和O
2混合气体的物质的量为10mol,
若剩余气体为氧气,设参加4NO
2+O
2+2H
2O=4HNO
3 反应消耗的氧气为x,则有消耗的NO
2为4x,即:5x=9mol,x=1.8mol.即氧气为2.8mol,V(NO
2)=7.2mol;
混合气体的总质量为7.2molNO
2与2.8molO
2的质量之和为7.2mol×46g/mol+2.8mol×32g/mol=420.8g,平均摩尔质量
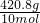
=42.08g/mol,平均分子量42.08;
若剩余气体为NO气体,则有3NO
2+H
2O=2HNO
3+NO,说明过量的NO
2为3mol,反应4NO
2+O
2+2H
2O=4HNO
3消耗的气体总体积为7mol,设反应消耗的氧气为y,则有消耗的NO
2为4y则有5y=7mol,y=1.4mol,即此时氧气为1.4mol,V(NO
2)=8.6mol;
混合气体的总质量为8.6molNO
2与1.4molO
2的质量之和为8.6mol×46g/mol+1.4mol×32g/mol=440.4g,平均摩尔质量

=44.04g/mol,平均分子量44.04;
故答案为:42.08或44.04.
分析:(1)B装置为块状不溶于水的固体和液体反应不加热制取气体的装置;
(2)实验室制得的氯气中有杂质气体水蒸气和氯化氢气体,盐酸能和碳酸氢钠反应产生二氧化碳气体;
(3)验证Cl
-和Br
-的还原性强弱可根据反应Cl
2+2Br
-=2Cl
-+Br
2设计实验;
(4)浓硝酸具有强氧化性,与铜反应生成二氧化氮气体;
(5)NO
2与水反应生成无色气体NO;
(6)先判断过量的气体的成分,若为氧气,然后根据 4NO
2+O
2+2H
2O=4HNO
3计算,求出参加此反应的NO
2和O
2,最后相加得到原来的氧气,若为NO,先根据3NO
2+H
2O=2HNO
3+2NO求出过量的NO
2,然后根据4NO
2+O
2+2H
2O=4HNO
3求出参加此反应的NO
2和O
2,最后相加得到原来的NO
2,最终根据M=
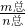
求平均摩尔质量,平均分子量和摩尔质量在数值上相等.
点评:本题考查较为综合,题目难度中等,注意制备气体的实验装置和反应原理以及NO
2、O
2和H
2O反应的计算,把握物质的主要性质,注重基础知识的积累.


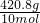 =42.08g/mol,平均分子量42.08;
=42.08g/mol,平均分子量42.08; =44.04g/mol,平均分子量44.04;
=44.04g/mol,平均分子量44.04;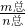 求平均摩尔质量,平均分子量和摩尔质量在数值上相等.
求平均摩尔质量,平均分子量和摩尔质量在数值上相等.



