
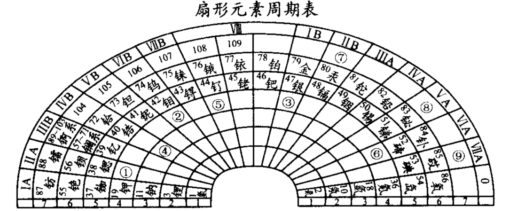
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol科目:高中化学 来源:不详 题型:单选题
| A.它是第五周期元素 |
| B.原子核内一定有82个中子 |
| C.铈的四种同位素形成的中性原子核外电子数相同 |
| D.Ce2+离子中有55个质子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E元素的核电荷数等于A原子和B元素氢化物的核电荷数之和 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与镓同主族且相邻周期的元素,其原子序数为23或49 |
| B.与镓同周期且相邻主族的元素,其原子序数为30或32 |
| C.原子半径:Br>Ga> Cl> Al |
| D.碱性:KOH>Ga(OH)3>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若原子X的质子数为a,则X的质量数一定不为a |
| B.若两种元素形成的离子M2-和N+电子层结构相同,则离子半径M2->N+ |
| C.同周期非金属氧化物对应水化物酸性从左到右依次增强 |
| D.由两种元素组成的化合物,若含有离子键,就没有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | a | | b | |
| 3 | c | d | e | f | | g | h | |
| 4 | J | | | | | | k | |
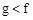
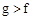
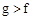
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com