
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
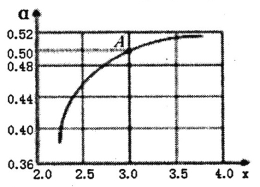
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
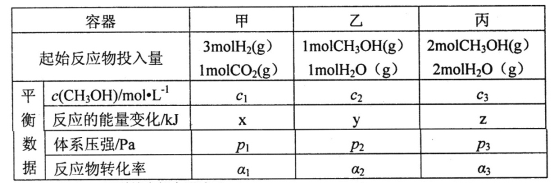
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
【答案】2NH3(g)+CO2(g)H2O(l)+CO(NH2)2(s) ΔH=-178 kJmol-1 33.3 Kp=108/p03 0.04 molL-1s-1 AB 1︰2或0.5 >
【解析】
本题研究CO2的综合利用对促进“低碳经济”的发展有重要意义,实际以CO2的性质为载体考查了化学反应原理的综合知识,难度适中。
(1) ①NH3、CO2为原料,合成尿素和液态水的热化学方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) △H,根据盖斯定律可知△H=△H1+△H2-△H3=-178 kJmol-1,因而有2NH3(g)+CO2(g)H2O(l)+CO(NH2)2(s) ΔH=-178 kJmol-1;
CO(NH2)2(s)+H2O(l) △H,根据盖斯定律可知△H=△H1+△H2-△H3=-178 kJmol-1,因而有2NH3(g)+CO2(g)H2O(l)+CO(NH2)2(s) ΔH=-178 kJmol-1;
②A点时,n(NH3)/n(CO2)=3.0,设n(CO2)=1mol,n(NH3)=3mol,CO2平衡转化率为0.50,则转化的CO2的量为1mol×0.50=0.5mol,那么根据2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)可知转化的NH3为0.5mol×2=1mol,NH3的平衡转化率
CO(NH2)2(s)+H2O(l)可知转化的NH3为0.5mol×2=1mol,NH3的平衡转化率![]() =1mol/3mol×100%=33.3%;
=1mol/3mol×100%=33.3%;
③当x=1.0时,设n(NH3)=n(CO2)=1mol,根据三段式可知:
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
起 1 1
转 2x x
平 1-2x 1-x
又若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2,可知![]() =
=![]() ,解得x=
,解得x=![]() mol,则n平(NH3)=
mol,则n平(NH3)=![]() mol,n平(CO2)=
mol,n平(CO2)=![]() mol,那么p平(NH3)=
mol,那么p平(NH3)=![]() ×
×![]() =
=![]() kPa,p平(CO2)=
kPa,p平(CO2)= ![]() ×
×![]() =
=![]() kPa,因而Kp=
kPa,因而Kp=![]() =
=![]() (kPa)-3;
(kPa)-3;
(2)①根据3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,可知消耗的CO2的量为1mol×
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,可知消耗的CO2的量为1mol×![]() =0.8mol,v(CO2)=
=0.8mol,v(CO2)=![]() =0.04mol·L-1·s-1;
=0.04mol·L-1·s-1;
②A.已知甲和乙为全等等效平衡,平衡时c1=c2,乙和丙的投料比相等,若处于恒压时,c2=c3*,c3*为恒压时丙中甲醇浓度,此时,丙是乙体积的两倍,但题目要求恒容,因而可将丙压缩一半体积,瞬间浓度为2c3*,由于压缩体积相当于加压,根据气体计量数可知,平衡向右移动,则甲醇浓度变大,因而c3>2c3*,综合上述分析可知c3>2c1,A正确;
B.乙和丙的投料比相等,假设在恒压时,c2=c3*,c3*为恒压时丙中甲醇浓度,由于丙是乙体积的两倍,丙中甲醇的消耗量是乙的两倍,可推出吸收的热量关系为z*=2y(注意乙和丙为逆反应,为吸热反应),z*为恒压时丙中热量变化,但题目要求恒容,因而可将丙压缩一半体积,由于压缩体积相当于加压,根据气体计量数可知,平衡向右移动,则甲醇的量变多,即吸收的热量减少,即z< z*,故z<2y,B正确;
C.根据B中分析可知平衡时,丙中甲醇的消耗量是小于乙中甲醇的消耗量的两倍,由于恒温恒容时压强之比等于物质的量之比,因而可推知丙中气体压强是小于乙中气体的两倍,即p3<2p2,C错误;
D.已知甲和乙为全等等效平衡,平衡时c1=c2,甲中α1=2c1/1=2c1,乙中α2=(1-2c2)/1=1-2c2,因而α1+α2=2c1+1-2c2=1,根据C可知平衡时,丙中甲醇的消耗量是小于乙中甲醇的消耗量的两倍,因而α3小于α2,所以α1+α3<1,D错误。
故答案选AB。
(3) pH=10,c(H+)=10-10mol/L,又K2(H2CO3)=![]() ,因而c(CO32-):c(HCO3-)= K2(H2CO3)/c(H+)=1︰2,溶液中电荷守恒关系式为c(Na+)+ c(H+)=c(HCO3-)+2c(CO32-)+ c(OH-),又溶液pH=10,则c(OH-)> c(H+),所以c(Na+)>c(HCO3-)+2c(CO32-)。
,因而c(CO32-):c(HCO3-)= K2(H2CO3)/c(H+)=1︰2,溶液中电荷守恒关系式为c(Na+)+ c(H+)=c(HCO3-)+2c(CO32-)+ c(OH-),又溶液pH=10,则c(OH-)> c(H+),所以c(Na+)>c(HCO3-)+2c(CO32-)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】依据反应2KIO3+5SO2+4H2O═I2+3H2SO4+2KHSO4(KIO3过量),利用下列装置从反应后的溶液中制取碘的CCl4溶液并回收KHSO4。下列说法不正确的是
A. 用 制取SO2B. 用
制取SO2B. 用 还原IO3-
还原IO3-
C. 用 从水溶液中提取KHSO4D. 用
从水溶液中提取KHSO4D. 用 制取I2的CCl4溶液
制取I2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列装置探究苯酚、醋酸、碳酸的酸性强弱,下列说法不正确的是( )

A. 装置a中试剂为醋酸,b中试剂为碳酸钠固体
B. 装置c中试剂为饱和碳酸氢钠溶液
C. 装置d中试剂为苯酚溶液
D. 酸性强弱顺序为:醋酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述中,正确的是( )
A.氧气的摩尔质量是32
B.2molNaCl固体溶解于1L水所得溶液的物质的量浓度为2mol/L
C.标准状况下同体积的O2和O3中所含分子数相等
D.在标准状况下,体积为22.4L的物质都是1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,体积都为V0mL、浓度都为0.1mol·L-1的MC1、NaR、MR三种盐溶液,加入蒸馏水稀释至VmL,溶液的pH与1g(V/V0)的关系如图所示。下列说法不正确的是

A. 曲线X代表NaR溶液,其中c(OH-)=c(H+)+c(HR)
B. 曲线Y中任何两点,水的电离程度都相同
C. 将等体积等物质的量浓度的MC1和NaR溶液混合后,c(M+)=c(R-)
D. 常温下,HR的电离常数Ka≈1×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮氧化物是形成光化学烟雾和酸雨的一个重要原因,用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:![]() △H=-1160kJ·mol-1
△H=-1160kJ·mol-1
![]() △H=+293kJ·mol-1
△H=+293kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为________________________。
(2)乙炔(CH≡CH)是重要的化工原料。工业上可用甲烷裂解法制取乙炔:![]() 同时发生副反应:
同时发生副反应:![]() ;甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。根据图判断,反应
;甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。根据图判断,反应![]() △H___0(填“>”或“<”)。
△H___0(填“>”或“<”)。

1725℃时,向恒容密闭容器中充入CH4,达到平衡时CH4生成C2H2的平衡转化率为_____。该温度下,![]() 的平衡常数Kp=_______[注:用平衡分压(Pa)代替平衡浓度(mol·L-1)进行计算]。
的平衡常数Kp=_______[注:用平衡分压(Pa)代替平衡浓度(mol·L-1)进行计算]。

(3)利用在特定条件下用铂电极(阳极为铂丝)电解饱和硫酸氢钾溶液的方法制备K2S2O8(过二硫酸钾)。在低温下电解液中主要含有K+、H+和![]() 离子,电流通过溶液后发生反应。阳极区电极反应式为______________________________,X为_________交换膜(填“质子”、“阳离子”或“阴离子”),当电路中通过0.2mol e-时,两边溶液质量的变化差为_________。
离子,电流通过溶液后发生反应。阳极区电极反应式为______________________________,X为_________交换膜(填“质子”、“阳离子”或“阴离子”),当电路中通过0.2mol e-时,两边溶液质量的变化差为_________。
(4)甲烷燃料电池采用铂为电极,两电极上分别通入CH4和O2,电解质溶液为300mL 1.0mol·L-1的NaOH溶液。当O2通入量为8.96L(标准状况)且反应完全时,所得溶液中各离子浓度由大到小的顺序为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是( )
A. 灼烧海带:
B. 将海带灰溶解后分离出不溶性杂质:
C. 制备Cl2,并将I-氧化为I2:
D. 以淀粉为指示剂,用Na2S2O3标准溶液滴定:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为__________,有较强的_________(填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_____________________。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是__________。该图示的总反应为_______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )

A. 盐酸中逐滴加入氢氧化钠溶液
B. 硫酸铜溶液中逐滴加入氢氧化钡溶液
C. 硫酸中逐滴加入氯化钡溶液
D. 盐酸中逐滴加入硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com