
【题目】![]() 和
和![]() 是两种主要的温室气体,以
是两种主要的温室气体,以![]() 和
和![]() 为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上![]() 催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
反应Ⅰ:![]() ;
;![]()
反应Ⅱ:![]() ;
;![]()
![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式是___________________。
的热化学方程式是___________________。
(2)将1 mol ![]() 和1 mol
和1 mol ![]() 加入恒温恒压的密闭容器中(温度298K、压强100kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率
加入恒温恒压的密闭容器中(温度298K、压强100kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率![]() ,p为分压(分压=总压×物质的量分数),若该条件下
,p为分压(分压=总压×物质的量分数),若该条件下![]() ,当
,当![]() 分解20%时,
分解20%时,![]() __________kPas-1。
__________kPas-1。
(3)将![]() 和
和![]() 在一定条件下反应可制得合成气,在1 L密闭容器中通入
在一定条件下反应可制得合成气,在1 L密闭容器中通入![]() 与
与![]() ,使其物质的量浓度均为
,使其物质的量浓度均为![]() ,在一定条件下发生反应:
,在一定条件下发生反应:,测得CH4的平衡转化率与温度及压强的关系如下图所示:
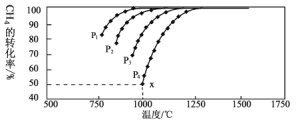
①压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的关系为_________。
由小到大的关系为_________。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作![]() ),如果
),如果![]() ,求x点的平衡常数
,求x点的平衡常数![]() ________________(用平衡分压代替平衡浓度计算)。
________________(用平衡分压代替平衡浓度计算)。
③下列措施中能使平衡正向移动的是___________(填字母)。
a.升高温度
b.增大压强
c.保持温度、压强不变,充入He
d.恒温、恒容,再充入1 mol ![]() 和1 mol
和1 mol ![]()
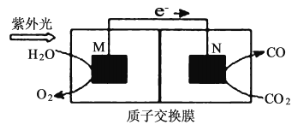
(4)科学家还研究了其他转化温室气体的方法,利用图所示装置可以将![]() 转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为_________极(填“正”或“负”),导线中通过2 mol电子后,假定体积不变M极电解质溶液的pH__________(填“增大”、“减小”或“不变”),N极电解质溶液变化的质量
转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为_________极(填“正”或“负”),导线中通过2 mol电子后,假定体积不变M极电解质溶液的pH__________(填“增大”、“减小”或“不变”),N极电解质溶液变化的质量![]() __________g。
__________g。
【答案】![]()
![]() 0.5
0.5 ![]()
![]() 或
或![]() acd 负 不变 18
acd 负 不变 18
【解析】
(1)反应Ⅰ:![]()
![]()
反应Ⅱ:![]() ;
;![]()
利用盖斯定律,将反应Ⅰ+反应Ⅱ,即可得出热化学方程式为![]()
![]() 。答案为:
。答案为:![]()
![]() ;
;
(2) 当CH4分解20%时,建立如下三段式:

![]() =4.5×10-4kPa-1s-1×(
=4.5×10-4kPa-1s-1×(![]() ×100kPa)×(
×100kPa)×(![]() ×100kPa)=0.5 kPas-1。答案为:0.5;
×100kPa)=0.5 kPas-1。答案为:0.5;
(3)①从方程式看,加压平衡逆向移动,CH4的转化率减小,由此得出压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的关系为
由小到大的关系为![]() 。答案为:
。答案为:![]() ;
;
②在x点,CH4的转化率为50%,建立三段式:

x点的平衡常数Kp= =
=![]() 或
或![]() 。答案为:
。答案为:![]() 或
或![]() ;
;
③a.从图象看,升高温度,CH4的转化率增大,则正反应为吸热反应,升高温度平衡右移,a符合题意;
b.反应物气体分子数小于生成物气体分子数,增大压强,平衡逆向移动,b不合题意;
c.保持温度、压强不变,充入He,则容器体积增大,平衡正向移动,c符合题意;
d.恒温、恒容,再充入1 mol ![]() 和1 mol
和1 mol ![]() ,则增大反应物浓度,平衡正向移动,d符合题意;
,则增大反应物浓度,平衡正向移动,d符合题意;
故选acd。答案为:acd;
(4)该装置工作时,M极由H2O失电子转化为O2,则其为负极;M极:2H2O-4e-=O2+4H+,N极:2CO2+4e-+4H+=2CO+2H2O,导线中通过2 mol电子,M极生成2molH+,同时有2molH+转移入正极,所以M极c(H+)不变,电解质溶液的pH不变;导线中通过2 mol电子,N极生成1molH2O,电解质溶液变化的质量![]() =1mol×18g/mol=18g。答案为:负;不变;18。
=1mol×18g/mol=18g。答案为:负;不变;18。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氨水中通入过量的SO2:2NH3·H2O + SO2 = 2NH4+ + SO32-+H2O
B.大理石与醋酸反应:CaCO3+2H+ =Ca2+ + H2O + CO2↑
C.向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2![]() 2Cu2++2H2O
2Cu2++2H2O
D.碳酸氢钠溶液和过量氢氧化钡溶液混合:2HCO3-+ Ba2+ + 2OH-== BaCO3↓+ CO32- + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(ZnS)=1.6×10-24;pM=-lgc(M2+)(M2+为Cu2+或Zn2+)。常温下,向10mL0.10mol·L-1CuCl2溶液中滴加0.10mol·L-1Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是

A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向上移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室制备少量1-溴丙烷的主要步骤如下:
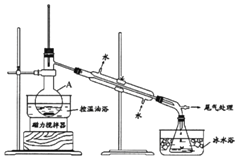
步骤1:在仪器A中加入搅拌磁子、12g 1-丙醇及20mL水,在冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr。
步骤2:缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分离出有机相。
步骤4:将分离出的有机相转入分液漏斗,依次用H2O、5%的Na2CO3溶液洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
已知:①1-溴丙烷沸点为71℃,密度为1.36g/cm3;
②反应过程中,在仪器A中可以观察到A的上方出现红棕色蒸气(Br2)。
回答下列问题:
(1)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(2)仪器A中主要发生反应为:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是______,同时可以观察到的现象是______。
(4)步骤4中的两次洗涤,依次洗去的主要杂质是______、_________。
(5)步骤4中的Na2CO3溶液还可以用下列中的______试剂代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作及现象所得出的解释或结论不正确的是( )
选项 | 实验操作及现象 | 解释或结论 |
A. | 向某溶液中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生 | 该溶液中一定含有SO |
B. | 向某溶液中加入浓NaOH溶液,加热,产生 能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
C. | 向某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3或KHCO3 |
D. | 酸性硝酸铁溶液中加入几滴碘化钾淀粉溶液,出现蓝色 | 铁离子具有较强氧化性,将I-氧化生成I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。以含钴废料(主要成分为Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下图所示:

已知:
Ⅰ.“酸浸”后的浸出液中含的阳离子有H+、Co2+、Fe3+、Ni2+等。
Ⅱ.部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 |
完全沉淀时的pH | 3.7 | 9.0 | 9.2 |
回答下列问题:
(1)“酸浸”含钴废料的温度不宜过高,原因是_____________。
(2) “酸浸”时发生的主要反应是___________________(写离子方程式)。
(3)某萃取剂对金属离子的萃取率与溶液pH的关系如图所示:
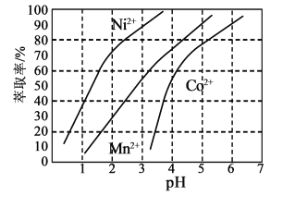
使用该萃取剂时应控制的pH约为____________,理由是_____________。
(4)写出高温煅烧时发生的化学反应方程式___________。
(5)操作1得到的副产品是__________(填名称);
已知该物质的溶液加热到100℃时会变质,该物质的溶解度见下表:
湿度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
溶解度 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 88.0 |
操作1是________(填字母)。
a.蒸发结晶 b.降温结晶 c.减压蒸发结晶
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由1-氯丁烷制取少量的1,2-丁二醇时,需要经过下列哪几步反应
A. 加成→消去→取代B. 消去→加成→水解
C. 取代→消去→加成D. 消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
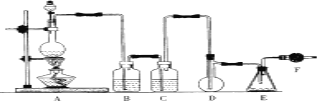
试回答下列问题:
(1)装置A中发生反应的化学方程式为______________________。
(2)装置B应盛放的药品是__________,C中是______________。
(3)实验时,D装置需加热至50—59℃.最好采用_____________方式加热。
(4)在配制一定物质的量浓度的盐酸溶液时,下列操作所配溶液浓度偏低的是__________;
A.配制溶液时,容量瓶中有少量水。
B.使用容量瓶配制溶液时,俯视观察溶液凹液面与容量瓶刻度线相切
C.配制溶液的过程中,容量瓶未塞好,洒出一些溶液。
D.发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com