
| A. | 原子半径的大小顺序:Z>R>X>Y | |
| B. | 元素非金属性由强到弱的顺序:X>R | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:X>Y | |
| D. | Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
分析 短周期主族元素X、Y、Z、R原子序数依次增大,Y是地壳中含量最多的元素,则Y为O元素;X原子最外层电子数是其核外电子总数的$\frac{2}{3}$,令其最外层电子数为a,则(2+a)×$\frac{2}{3}$=a,解得a=4,故X为C元素;同周期主族元素中Z原子半径最大,处于IA族,原子序数大于氧,故Z为Na;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R原子核外电子数为6+11=17,故R为Cl.
解答 解:短周期主族元素X、Y、Z、R原子序数依次增大,Y是地壳中含量最多的元素,则Y为O元素;X原子最外层电子数是其核外电子总数的$\frac{2}{3}$,令其最外层电子数为a,则(2+a)×$\frac{2}{3}$=a,解得a=4,故X为C元素;同周期主族元素中Z原子半径最大,处于IA族,原子序数大于氧,故Z为Na;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R原子核外电子数为6+11=17,故R为Cl.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径Z(Na)>R(Cl)>X(C)>Y(O),故A正确;
B.非金属性Cl元素强于碳元素的,故B错误;
C.碳元素非金属性弱于氧元素,故碳元素氢化物稳定性也较弱,故C错误;
D.Y与Z形成的两种化合物为氧化钠、过氧化钠,均属于离子化合物,氧化钠只含有离子键,而过氧化钠含有离子键、共价键,故D错误.
故选:A.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,推断元素是解题关键,有利于基础知识的巩固.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
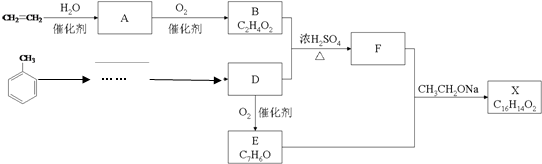
 .
.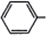 CH2OCH2CH2CHO
CH2OCH2CH2CHO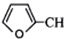 =CHCH2CH2CHCHO
=CHCH2CH2CHCHO COOCH2CH2CH3
COOCH2CH2CH3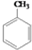 到D的合成路线(无机试剂任选,用合成路线流程图表示).
到D的合成路线(无机试剂任选,用合成路线流程图表示).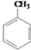 → → |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl- | |
| B. | 0.1 mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO4 2-、Cl- | |
| C. | 0.1 mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| D. | c(H+):c(OH-)=1012mol•L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水果表面喷洒驱虫剂不招苍蝇 | B. | 自来水使用氯制剂以杀菌消毒 | ||
| C. | 牛肚用甲醛浸泡使其口感更好 | D. | 生豆芽时用植物生长激素提高产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| B. | NaCl$\stackrel{通电}{→}$Na$\stackrel{TiCl_{4}溶液}{→}$ Ti | |
| C. | MgCl2•6H2O $\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O | |
| B. | 充电时每转移2 mol电子,阴极有1 mol Cd(OH)2被氧化 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
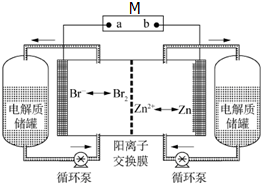 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )| A. | 锌溴液流电池总反应为:Zn+Br2═ZnBr2 | |
| B. | 放电时右侧电池电极发生氧化反应,电流从a极经用电器流向b极 | |
| C. | 放电时Zn2+从右侧经阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大 | |
| D. | 充电时左侧溴离子浓度下降,左侧电池电极连接电源的负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com