
【题目】某强酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,转化关系如图所示。反应过程中有一种气体在空气中会变为红棕色。回答下列问题:

(1)沉淀C是___(填化学式),由此可确定溶液X中肯定不存在的阳离子有___。
(2)气体A是___(填化学式),产生气体A的离子方程式为___。
(3)步骤④中发生反应的离子方程式为___。
(4)根据题给信息和图中转化关系,可以确定溶液X中肯定存在的离子有___,可能存在的离子有___。
【答案】BaSO4 Ba2+ NO 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Al3+、NH4+、SO42-、Fe2+ Fe3+
【解析】
①溶液X为强酸性,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液X和硝酸钡溶液反应生成沉淀C,则溶液X中存在SO42-,不存在和硫酸根离子反应的Ba2+,沉淀C是BaSO4;
②酸性条件下硝酸根离子具有强氧化性,溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,在空气中会变为红棕色,则溶液中存在Fe2+、不存在NO3-,气体A是NO;
③溶液B中加入氢氧化钠溶液、加热时,产生气体D,则溶液中含有NH4+,D是NH3,产生沉淀E,则E中含有Fe(OH)2,可能含有Fe(OH)3;
④溶液F中通入过量CO2生成沉淀H,则溶液X中含有Al3+;
综上,强酸性溶液X中:溶液X中肯定不存在的离子有CO32-、SiO32-、NO3-、Ba2+,肯定存在的离子有Al3+、NH4+、Fe2+、SO42-,可能存在的离子为Fe3+。
(1)溶液X为强酸性,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液X和硝酸钡溶液反应生成沉淀C,则溶液X中存在SO42-,不存在和硫酸根离子反应的Ba2+,沉淀C是BaSO4;
(2)酸性条件下硝酸根离子具有强氧化性,加入硝酸钡产生气体,在空气中会变为红棕色,则溶液中存在Fe2+、不存在NO3-,气体A是NO,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(3)溶液F中通入过量CO2生成沉淀H,步骤④中发生反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(4)根据题给信息和图中转化关系,强酸性溶液X中:溶液X中肯定不存在的离子有CO32-、SiO32-、NO3-、Ba2+,肯定存在的离子有Al3+、NH4+、Fe2+、SO42-,可能存在的离子为Fe3+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 三种短周期元素,其原子半径的大小顺序为
三种短周期元素,其原子半径的大小顺序为![]() ,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中
,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中![]() 为
为![]() 、
、![]() 组成的双原子分子,
组成的双原子分子,![]() 和
和![]() 均为10电子分子。下列判断错误的是( )
均为10电子分子。下列判断错误的是( )
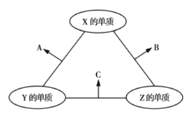
A.![]() 的最外层电子数为6
的最外层电子数为6
B.![]() 和
和![]() 之间不可能发生氧化还原反应
之间不可能发生氧化还原反应
C.![]() 的沸点高于
的沸点高于![]() 的沸点
的沸点
D.![]() 不能溶于
不能溶于![]() 中
中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、L、M,原子序数依次递增。X是原子半径最小的元素,Y的最高正价和最低负价的代数和为0,Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,L的最外层电子数是次外层的3倍,M是地壳中含量最高的金属元素。
回答下列问题:
(1)五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C。实验室制取B的化学方程式为______。
(3)Z的最高价氧化物对应水化物与M的最高价氧化物对应水化物反应的离子方程式为_______。
(4)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,测得平衡时NO2与SO2体积比为1:6,则平衡常数K=______。
(2)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列各小题:
CH3OH(g)。根据题意完成下列各小题:

①反应达到平衡时,平衡常数表达式K=______。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=_____。(用图中出现的字母表示)
③甲醇—空气燃料电池是一种环境友好型碱性电池,该电池放电时,负极的反应式为_____。
④甲醇是未来的重要的能源物质,常温下,1g甲醇液体完全燃烧生成液态水时放出22.7kJ的能量,写出甲醇燃烧热的热化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:___。
(2)配平该方程式:__FeC2O4·2H2O+__H2O2+__K2C2O4+__H2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式___;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:K=![]() 。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
![]()
(1)A、B、C之间有如图的转化关系,若A为AlCl3,写出A和C反应的离子方程式:_______________;
(2)检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是_____________ 、_______________
(3)已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式____________________。
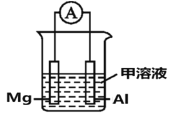
(4)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为__________。若电解液为氢氧化钠溶液,负极的电极反应为________________。
(5)写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:__________________。
(6)若铅蓄电池负极质量增加19.2g,则其正极质量增加____________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于元素周期表中下列位置的①~⑩10种元素,请用元素符号或化学式回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | ② | ||||||
二 | ③ | ④ | ⑤ | ⑥ | ||||
三 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑦在元素周期表中的位置____________。
(2)以上元素所形成的最高价含氧酸酸性最强的酸是____________,(填化学式,下同)碱性最强的碱是____________。它们与⑨的单质反应的离子方程式分别为____________、____________。
(3)④⑤⑥的原子半径的由大到小顺序为____________。(填元素符号)③④⑤⑥的最简单氢化物的稳定性由弱到强的顺序为____________。
(4)⑤⑦的一种1:1型化合物X的电子式为____________。X能和①⑤组成的一种化合物Y反应生成⑤的单子,则化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是
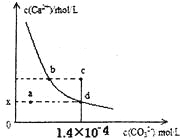
A. x的数值为2×10-5
B. c点时有CaCO3生成
C. 加入蒸馏水可使溶液由d点变成 a点
D. b点与d点对应的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式:_________________________________ 。
(2)该反应的△H _________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中____点,比较图中B、D两点所对应的正反应速率υB_______υD,理由是____。

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com