
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. 1s22s22p63s23p5 B. 1s22s22p3
C. 1s22s22p2 D. 1s22s22p63s23p4
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、E、F、G七种元素为周期表中原子序数依次增大的前四周期元素。6X的一种核素能用于测定文物的年代;Y元素最高价氧化物对应水化物能与其常见氢化物反应生成盐M;Z原子核外成对电子数是未成对电子数的3倍;W的原子半径在同周期主族元素中最大;E的基态原子的所有电子位于四个能级且每个能级均全充满;F的电负性在同周期中最大;G的基态原子N层只有一个电子,内层电子全部排满。请回等下列问题: (用X、Y、Z、W、E、F、G所对应的元素符号表示)
(1)写山F的基态原子的核外电子排布式:______________。
(2)Y、Z、W的电负性由大到小的顺序为_____________。
(3)以下可以表示X的基态原子的原子轨道表示式的是____________。
A. ![]() B.
B. ![]() C.
C. ![]()
(4)下图可以表示F的氢化物中电子云重叠方式的是_______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(5)基态E原子核外存在_____种运动状态不同的电子。
(6)G元素位于周期表中的_____区,基态原子价电子排布式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另—个盛有H2和Cl2的混合气体。在同温同压下, 两容器内的气体一定具有相同的( )
A. 原子数 B. 密度 C. 质量 D. 质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
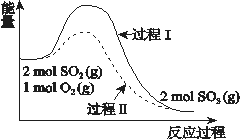
A. 2SO2(g) + O2(g) ![]() 2SO3(l) ΔH > a kJ/mol
2SO3(l) ΔH > a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molSO2(g) 和1mol O2(g)置于一密闭容器中充分反应后放出或吸收的热量小于┃a┃ kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )
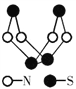
A. 该物质的分子式为SN
B. 该物质的晶体中微粒间作用力有2种
C. 该物质具有很高的熔、沸点
D. 该物质与化合物S2N2互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础。
实验室欲分离乙酸(沸点为118℃)和乙醇(沸点为78℃)的混合物,请按要求作答。
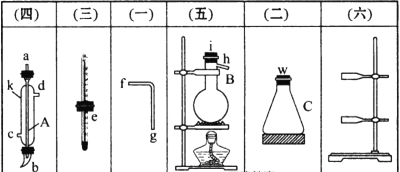
(1)图中A、B两种仪器的名称是________、________。
(2)A仪器中进水口是________(填“c”或“d”)。
(3)分离混合物时,温度计的________应处于______________。
(4)在B中注入混合物后,加入几片碎瓷片的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-===3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是( )
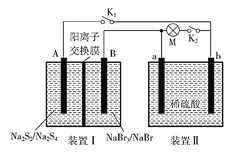
A. 闭合K1、K2时,每有0.1 mol Na+通过离子交换膜,装置II溶液中有0.1mol电子转移
B. 装置Ⅰ放电时的A电极反应式为2Na2S2-2e-===Na2S4+2Na+
C. 断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+===PbSO4+2H2O
D. 断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:

①捕获1mo1CO2转移电子的物质的量是_________。
②过程2反应的化学方程式是________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。

①正反应的焓变△H_________0。
②提高CO2的转化率,可采用的方法是______。
a.增大n(CO2)与n(H2)的投料比
b.改变催化剂
c.缩小容器体积
③图中表示水的曲线是_____。
(3)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极将CO2转化为丙烯的原理模型。

①太阳能电池的正极是________。
②生成丙烯的电极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但不属于四种基本反应类型的是 ( )
A. CuO + H2 ![]() Cu + H2O B. Fe2O3 + 3CO
Cu + H2O B. Fe2O3 + 3CO ![]() 2Fe + 2CO2
2Fe + 2CO2
C. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑ D. NaOH + HCl = NaCl + H2O
K2MnO4 + MnO2 + O2↑ D. NaOH + HCl = NaCl + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com