
| A. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| B. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 | |
| C. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| D. | 纳米材料 微粒直径从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
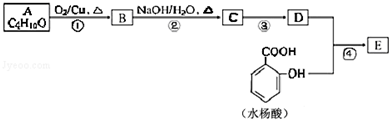
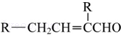 ;
;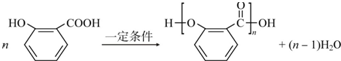 .
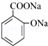
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素属于无机化合物 | |
| B. | 青蒿素属于氧化物 | |
| C. | 标准状况下,1mol青蒿素的体积约为22.4L | |
| D. | 青蒿素的摩尔质量为282g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
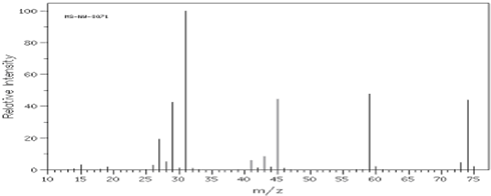
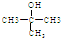 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 | |
| B. | NaCl的电子式: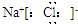 | |
| C. | F+的结构示意图: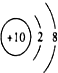 | |
| D. | Fe3+的最外层电子排布式为3s23p63d5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com