
| 组别 | c(HA)/mo1?L-1 | c(NaOH)/mo1?L-1 | 混合液pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:


| SOCl2 |
| R?OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验测定化学反应速率 |
B、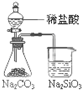 能证明非金属性 Cl>C>Si |
C、 实验制取并收集NH3 |
D、 滴定法测定盐酸浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和环丙烷 |
| B、CH≡C-CH3和CH2=CH-CH=CH2 |
| C、2,2-二甲基丙烷和2-甲基丁烷 |
| D、乙烯和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X极是电源的负极,Y极是电源的正极 |
| B、Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体 |
| C、电解过程中CuSO4溶液的pH逐渐增大 |
| D、a极的电极反应式为2Cl--2e-═Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com