
����Ŀ��ij��Ӧ�з�Ӧ������������FeCl2��FeCl3��CuCl2��Cu
��1����������Ӧ��Ƴɵ�ԭ�����ͼ����ʾ����ش��������⣺
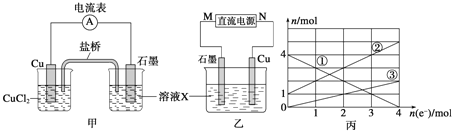
��ͼ��X��Һ��______________________��
��Cu�缫�Ϸ����ĵ缫��ӦʽΪ_________________��
��ԭ��ع���ʱ�������е�_______________���ӣ��K+����Cl-�������Ͻ���X��Һ�С�
��2����������Ӧ��Ƴɵĵ�����ͼ����ʾ�����ձ��н��������ӵ����ʵ��������ת�Ƶ����ʵ����ı仯��ϵ��ͼ������ش��������⣺
��M��___________����
��ͼ���еĢ�����_______________���ӵı仯��
�۵�����ת��Ϊ2molʱ�������ձ��м���_________L 5mol��L-1NaOH��Һ����ʹ���еĽ��������ӳ�����ȫ��
��3������ԭ��ع���ԭ���ⶨ����β����CO��Ũ�ȣ���װ����ͼ��ʾ���õ����O2-�����ڹ������NASICON�������壩�������ƶ�������ʱO2-���ƶ�����_____________�����a��b����b��a���������������ĵ缫��ӦʽΪ____________________��

��4������������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ����ͼ��ʾ����������ĵ缫��Ӧʽ��_________________________��A��___________________��
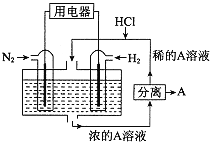
���𰸡� FeCl3�� FeCl2 Cu-2e-=Cu2+ K+ �� Fe2+ 2.8 ��b��a CO-2e-+O2-=CO2 N2+6e-+8H+=2NH4+ NH4Cl
�������������������1�����Ȼ�������ǿ�����ԣ�ͭ�ܱ��Ȼ�����������ӦΪ��ӦΪ2FeCl3+Cu=CuCl2+2FeCl2����Cu���Ȼ�����Ӧ��ͭʧ���ӷ���������Ӧ������������ʯī�����������������������������ƶ�����2�����ݱ�ͼ��֪��Һ�������ֽ��������ӣ�������X�ijɷֿ�֪X��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����Cu��������ʯī������������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯ȷ�����߶�Ӧ�����ӣ����ת�Ƶ��ӵ����ʵ������㣻��3��һ����̼�����γ�ȼ�ϵ�أ�һ����̼��������Ӧ���ɶ�����̼��ͨ��CO��һ���Ǹ�����ͨ��������һ����������ԭ��طŵ�ʱ���������ƶ�����4�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ��������HCl��Ӧ�����Ȼ�泥���������ҺΪ�Ȼ����
��������1�����Ȼ�������ǿ�����ԣ�ͭ�ܱ��Ȼ������������Է�ӦΪ2FeCl3+Cu=CuCl2+2FeCl2����FeCl3��ҺΪ�������Һ����Cu��������ʧ���ӷ���������Ӧ���缫��ӦΪCu-2e-=Cu2+����ʯī���������ŵ�ʱ���������������������������е�������K+����X��Һ�У���2���ٸ��ݱ�ͼ��֪��Һ�������ֽ��������ӣ�������X�ijɷֿ�֪X��ֻ�����ֽ��������ӣ�˵���ڵ������л���Cu2+���ɣ����Cu��������ʯī������������M�Ǹ������ڸ���ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ΪFe3+����ΪFe2+����ΪCu2+��������ת��Ϊ2molʱ����Һ����Fe3+2mol��Fe2+3mol��Cu2+Ϊ1mol��������Ҫ����NaOH��Һ14mol������NaOH��Һ�����Ϊ![]() 2.8L����3������ͼ��֪��һ����̼�����γ�ȼ�ϵ�أ�һ����̼ʧ���Ӻ������ӷ�Ӧ���ɶ�����̼����������Ӧ���缫��ӦʽCO-2e-+O2-=CO2������һ����̼���ڼ�Ϊ������ͨ�������һ��Ϊ������ԭ��طŵ�ʱ���������ƶ������Թ���ʱO2-���ƶ������b��a����4�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ����������ӦʽΪN2+8H++6e-=2NH4+��������HCl��Ӧ�����Ȼ�泥���������ҺΪNH4Cl��Һ��
2.8L����3������ͼ��֪��һ����̼�����γ�ȼ�ϵ�أ�һ����̼ʧ���Ӻ������ӷ�Ӧ���ɶ�����̼����������Ӧ���缫��ӦʽCO-2e-+O2-=CO2������һ����̼���ڼ�Ϊ������ͨ�������һ��Ϊ������ԭ��طŵ�ʱ���������ƶ������Թ���ʱO2-���ƶ������b��a����4�����������ʧ���ӣ��ڸ�������������Ӧ�������õ���������������ԭ��Ӧ����������ӦʽΪN2+8H++6e-=2NH4+��������HCl��Ӧ�����Ȼ�泥���������ҺΪNH4Cl��Һ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڿ�ѧ�о���ҵ�����о���������;����ش��������⣺
��1��Cu2O�������ӵĻ�̬��������Ų�ʽΪ__________________�� Cu��Ni��Ԫ�����ڱ��е�λ�����ڣ� Ni�����ڱ��е�λ����__________________��
��2���������İ�ˮ�ӵ�����ͭ��Һ�У���Һ���ձ������ɫ�����������Ҵ�����������ɫ�ľ��� [Cu( NH3)4]SO4��H2O��
���Ҵ�������C ԭ�ӵĹ���ӻ�����Ϊ__________________��NH3��H+����λ���γ�NH4+����NH4+�Ŀռ乹��Ϊ____________________��
��[Cu( NH3)4]SO4��H2O]�д��ڵĻ�ѧ�����˼��Թ��ۼ��⣬����____________________��
��NH3��������ˮ��ԭ����Ҫ��������һ��_______________������_______________________��
��3��CuSO4��Һ�м������KCN��Һ������������[Cu(CN)4]2-��1mol CN-�к��еĦм���ĿΪ__________����CN-��Ϊ�ȵ������������____________��д��һ�ּ��ɣ���
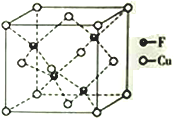
��4��Cu ��F�γɵĻ�����ľ����ṹ��ͼ��ʾ���������ܶ�Ϊa g��cm-3����Cu��F�������Ϊ____________pm����NA��ʾ�����ӵ�������ֵ,�г��������ʽ�����û���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ֱ��Ǽס�������ͬѧ����Ӧ ��AsO43-��2I����2H��![]() AsO33����I2��H2O����Ƴɵ�ԭ���װ�ã�����C1��C2��Ϊ̼����������ͼ���ձ�����μ�������Ũ���������ͼ��B�ձ�����μ�������40%NaOH��Һ��
AsO33����I2��H2O����Ƴɵ�ԭ���װ�ã�����C1��C2��Ϊ̼����������ͼ���ձ�����μ�������Ũ���������ͼ��B�ձ�����μ�������40%NaOH��Һ��
������������ȷ���ǣ� ��
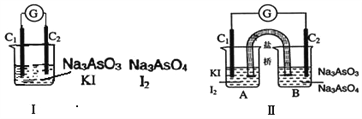
A. �������ʱ��������G��ָ�뷢��ƫת
B. �������ʱ����Һ��ɫ��dz
C. �������ʱ��C2������
D. �������ʱ��C1�Ϸ����ĵ缫��ӦΪI2��2e��=2I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С����Ҫ1 molL��1��CuSO4 ��Һ80 mL�����õ�����CuSO4��5H2O�������ƣ���ش��������⣺
��1�����ȡ���� ______g��
��2�����ƹ����У�����Ҫ������������ţ�________��
A��ҩ�� B���ƾ��� C��������ƽ D���ձ� E�������� F��������
�������ʵ�黹ȱ�ٵ�������________��
��3�������ƹ����У����в���������������ҺŨ��ƫ�͵���_____������ţ���
��ת��ǰ������ƿ�к�����������ˮ ��ת��ʱ������Һ�彦��
�۶���ʱ�����ӿ̶��� �� �ܵߵ�ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ۺ���ۻ�Ϻ���ȣ�����Ӧһ������ֹͣ���ȣ���Ӧ�Կɳ������У�ֱ����Ӧ��ȫ������������������������˵����
A. �÷�Ӧ�����ȷ�Ӧ
B. �÷�Ӧ�Ƿ��ȷ�Ӧ
C. ���ۺ�����ڳ����¿��Է�����Ӧ
D. ���������������������ۺ���۵�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ�IJ����в����ܴ���ͬ���칹�����( )
A. CH3CH=CH2��HCl�ӳ�
B. CH3CH2CH2Cl�ڼ�����Һ��ˮ��
C. CH2=CH��CH=CH2��H2�����ʵ���֮��Ϊ1��1���з�Ӧ
D. ![]() ��NaOH�Ĵ���Һ����
��NaOH�Ĵ���Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C���ǽ�������A����C����������Һ�У�A�ı�����C������A��B������Һ���ԭ���ʱ��BΪ������A��B��C���ֽ����Ļ��˳��Ϊ
A.A>B>CB.A>C>BC.B>A>CD.B>C>A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⱥ��NaCl��Һ�ǻ�ѧ��ҵ����Ҫ��Ӧ֮һ��20��ʱ������NaCl��Һ���ܶ�Ϊ��g��cm-3(�ѣ�1g��cm-3)�����ʵ���Ũ��ΪC mol��L-1�����ʵ���������w%��������˵���в���ȷ����
A. �¶ȸ���20��ʱ������NaCl��Һ���ܶȴ��ڦ�g��cm-3
B. ����Һ��NaCl����������Ϊ58.5C/(1000��)%
C. 20��ʱ��Ũ��С��C mol��L-1��NaCl��Һ�Dz�������Һ
D. 20��ʱ��ȡ1L����NaCl��Һ������������ˮϡ�ͣ�������Һ�������������ڣ�w/2��%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com