
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐。易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
I.亚硝酸钠的制备

(1)实验中用恒压滴液漏斗,相比于普通分液漏斗,其显著优点是___________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的化学反应方程式__________________。
Ⅱ.探究亚硝酸钠与硫酸反应气体产物的成分
已知:①NO+NO2+2OH-=2NO2-+2H2O ②气体液化的温度:NO2 为21℃、NO为 -152℃

(3)反应前应打开弹簧夹,先通入一段时间的氮气,目的是___________________。
(4)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接)为A、C、_______、_______、_______。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体。
①确认A中产生气体含有NO,依据的现象是____________________________。
②装置E的作用是__________________________________________________。
(6)如果没有装置C,对实验结论造成的影响是________________________。
(7)通过上述实验探究过程,可得出装置A中反应的离子方程式是__________________。
【答案】 平衡滴液漏斗与烧瓶中的压强,有利于稀硝酸顺利流下 4NO+O2+Na2CO3==4NaNO2+2CO2 防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰 E D B D中通入氧气后,气体由无色变为红棕色 冷凝,使NO2完全液化 水蒸气存在,会与NO2反应产生NO,造成对NO的来源认识不清 2NO2-+2H+ ==NO2↑+NO↑+H2O
【解析】(1)相比于普通分液漏斗,恒压滴液漏斗可以平衡滴液漏斗与烧瓶中的压强,有利于稀硝酸顺利流下。(2)D中澄清石灰水变浑浊,说明有二氧化碳生成,则C中制备NaNO2的化学反应方程式为4NO+O2+Na2CO3==4NaNO2+2CO2。(3)装置中含有空气,空气能氧化反应中生成的NO,所以先通入一段时间的氮气,目的是防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰;(4)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,所以装置的连接为A→C→E→D→B;(5)①D中通入氧气后无色气体变成红色,说明含有NO气体;②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,所以装置E的作用是冷凝使NO2完全液化;(6)如果没有装置C,水蒸气会存在,水蒸气与NO2反应产生NO,造成对NO的来源认识不清;(7)通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成,所以反应的离子方程式为2NO2-+2H+ ==NO2↑+NO↑+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数值。下列说法正确的是
表示阿伏加德罗常数值。下列说法正确的是
A. 标准状况下,2.24 LNO2与N204的混合气体中含有氮原子的数目为0.1![]()
B. 若1 L 0.2 mol/L的FeCl3溶液完全水解形成胶体,则胶体粒子数为0.2![]()
C. 标准状况下,22.4L SO2中含有的氧原子数为3.0![]()
D. 常温下,Na202与H20反应生成lmol02时,转移电子数是2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列叙述正确的是
A. 0.1 mol丙烯酸中含有双键的数目为0.1NA
B. 常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C. 一定条件下定容容器中充入3molH2(g)和1 mol N2(g)发生反应:H2(g)+ N2(g)![]() 2NH3(g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
2NH3(g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA
D. 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中的SOj是常见的大气污染物,可通过以下几种方式变废为宝:
(1)电化学处理法:硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料)写出N极发生的电极反应式________________________;溶液中的阳离子向______极(M或N)移动,标准状况下,当有22.4LSO2参加反应时,溶液中有________mol阳离子向该极移动。
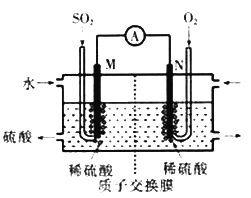
(2)钠碱循环法:用Na2SO3溶液作为吸收液来吸收SO2,尾气通入1mol/L的Na2SO3溶液中,①当溶液的PH约为6时,Na2SO3溶液吸收SO2的能力显著下降,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为_______________。
②当溶液的PH降至约为6时,需送至电解槽再生,再生示意图如下:
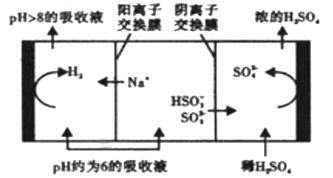
HSO3-在阳极放电的电极反应式是______________________________。
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入M (g)和N (g),发生反应M (g) +N (g) ![]() 2P (g) +Q (s),所得实验数据如下表:
2P (g) +Q (s),所得实验数据如下表:

下列说法正确的是
A. 实验①中,若5 min时测得n(N) = 0.050 mol,则0~5min时间内平均反应速率v(P) = 0.015 mo1/(L·min)
B. 实验②中达到平衡后,增大压强,M的转化率增大,平衡常数不变
C. 600℃时该反应的平衡常数K=3.0
D. 实验③中,达到平衡时,x<0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水,煤和石油燃烧的废气中也含有颗粒状的铬。
(1)某兴趣小组拟定以下流程,对含Cr3+、Fe2+等离子的废水进行无害化处理。

请回答下列问题:
①写出加入双氧水后发生反应的离子方程式:_____________________________。
②过滤操作需要的玻璃仪器有________________________________________。
③活性炭的作用是__________________________________________________。
(2)工业含铬废水中铬常以Cr2O![]() 形式存在,可按下列流程来除去废水中的铬。
形式存在,可按下列流程来除去废水中的铬。

①写出还原池中发生反应的离子方程式:________________________________。
②石灰水处理后生成的沉淀有______(用化学式表示)。
③现处理1×102L含铬(Ⅵ)39 mg·L-1的废水,需要绿矾________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 1 mol Cl2中含有的原子数为NA
B. 标准状况下,a L氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
C. 标准状况下,22.4 L水中所含的分子数约为6.02×1023个
D. 从1 L0.5 mol·L-1NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com