
【题目】Ⅰ. 由中科院等离子体物理研究所自主研制的全超导托卡马克实验装置(俗称“人造太阳”)正在接受技术升级。人造太阳是利用氘、氚核聚变反应释放巨大能量原理而实现的。下列说法正确的是________。
A.氕、氘、氚三种元素在周期表中的位置不同
B.20 g D2O含有的中子数为6.02×1024个
C.在隔绝空气和高温下LiCl与金属钠反应可获得金属锂
Ⅱ. 部分元素在周期表中的位置如下:
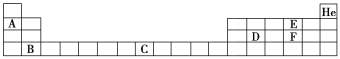
请回答下列问题:
(1)元素C在周期表中的位置为________。
(2)判断E和F对应的简单氢化物沸点高低,并解释原因____________。
(3)用电子式表示F的氢化物的形成过程:___________。
Ⅲ.溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如下:

(1)结合元素周期律解释Cl的非金属性强于Br的原因:_______________。
(2)吸收塔中,A吸收了Br2后的溶液中含有Br和BrO3,则A是________(填序号)。
A.NaCl溶液 B.Na2CO3溶液 C.SO2气体
(3)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是______。
【答案】BC 第四周期Ⅷ族 H2O沸点高,水分子可形成分子间氢键作用力强,故沸点高 ![]() Cl和Br均为第ⅦA族元素,原子最外层电子数均为7,电子层数Cl<Br,原子半径Cl<Br,得电子能力Cl>Br,非金属性Cl>Br B 5Br+ BrO3 + 6H+ =3Br2 + 3H2O
Cl和Br均为第ⅦA族元素,原子最外层电子数均为7,电子层数Cl<Br,原子半径Cl<Br,得电子能力Cl>Br,非金属性Cl>Br B 5Br+ BrO3 + 6H+ =3Br2 + 3H2O
【解析】
A.氕、氘、氚三种元素为H的同位素,质子数相同;
B.D2O的摩尔质量为20g/mol,则20g D2O即1mol;
C.还原性:Na>Li,在隔绝空气和高温下LiCl与金属钠反应可获得金属锂;
Ⅱ.根据元素周期表的信息,A为Li,B为Ca,C为Fe,D为Si,E为O,F为S。
Ⅲ.苦卤中的溴离子与氯气反应生成溴,在吹出塔经热空气吹出溴蒸气,在吸收塔吸收,生成Br和BrO3,再与稀硫酸反应生成单质溴。
A.氕、氘、氚三种元素为H的同位素,质子数相同,则在周期表中的位置相同,A错误;
B.D2O的摩尔质量为20g/mol,则20g D2O即1mol,1mol D2O含有的中子的物质的量为10mol,所以1mol含有的中子数为6.02×1024个,B正确;
C.还原性:Na>Li,在隔绝空气和高温下LiCl与金属钠反应可获得金属锂,C正确;
答案为BC;
II.(1)元素C为Fe,位于第四周期Ⅷ族;
(2)E和F分别为O、S,氢化物为H2O、H2S,水分子间可形成氢键,导致分子间的作用力增大,熔沸点升高,则H2O沸点高;
(3)F的氢化物为H2S,电子式表示其形成过程为![]() ;
;
III.(1)Cl、Br属于同一主族,最外层均有7个电子,Cl原子核外有3个电子层,Br有4个电子层,则原子半径Cl<Br,原子核对核外电子的作用力Cl>Br,得电子能力Cl>Br,则非金属性:Cl>Br;
(2)Br2在碱性溶液中生成Br和BrO3,结合题中给定试剂,答案为B;
(3)Br和BrO3,在酸性条件下生成溴和水,反应的离子方程式为5Br+BrO3+6H+ =3Br2+ 3H2O。


科目:高中化学 来源: 题型:
【题目】某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:
① | ② | ③ |
|
|
|
溶液变红,约10秒后红色褪去,产生能使带火星木条复燃的气体,取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有能使带火星木条复燃的气体产生,产物经检验有丁达尔效应 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,产物经检验无丁达尔效应 |
下列说法错误的是
A.②中红色溶液中含有Fe(OH)3胶体
B.实验②中发生的氧化还原反应只有两种
C.对比①②,可以判定酸性条件下H2O2可以氧化SCN-
D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组为探究![]() 在酸性
在酸性![]() 溶液中的反应,利用如图装置进行实验:
溶液中的反应,利用如图装置进行实验:
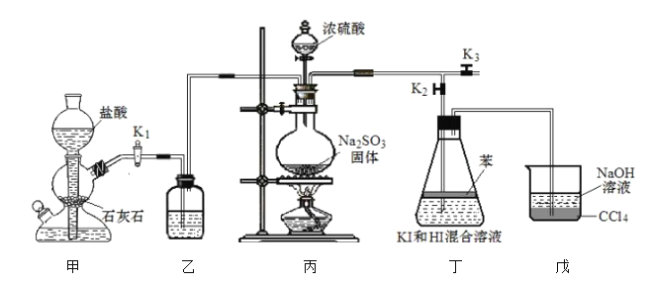
I.排出装置内的空气。减缓![]() 的流速,向丁装置中通入
的流速,向丁装置中通入![]() 和
和![]() 的混合气体。
的混合气体。
Ⅱ.一段时间后,溶液变黄并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入![]() 和
和![]() 混合气体,溶液变为无色。
混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
回答下列问题:
(1)苯的作用为__________。排出装置内空气的具体操作为_________。
(2)向装置丁中缓慢通入![]() 的作用是__________。
的作用是__________。
(3)步骤Ⅱ反应的离子方程式为__________;步骤Ⅲ反应的离子方程式为______________。
(4)实验的总反应为_________,![]() 和
和![]() 在反应中的作用为___________。
在反应中的作用为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥ B. ②③⑤ C. 全部 D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“信阳毛尖”是一种绿茶,绿茶中含有的单宁酸(化学式为C76XnO46)具有抑制血压上升、清热解毒等功效。回答下列问题:
(1)已知单宁酸完全燃烧时得到CO2、H2O,则X代表______元素,单宁酸的摩尔质量是1700g·L-1,则n=______,170g单宁酸完全燃烧时可得到______gH2O。
(2)若170g单宁酸某次燃烧时生成了3.6molCO2,则生成的CO最多______g,此种情况下恢复到常温,所得混合气体的平均摩尔质量为______(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________,含有的官能团为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证浓硫酸和木炭粉在加热条件下产生的产物,某同学选用了如图所示的实验装置。下列说法错误的是( )
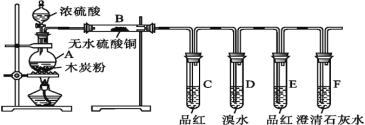
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.F装置用来检验产物中是否有CO2生成
D.将装置B与C位置互换,仍可以达到实验目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
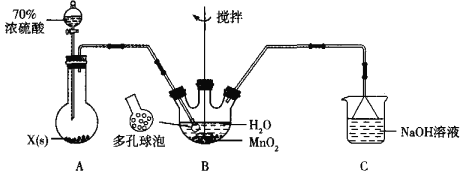
①A装置中固体药品X通常是______填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______;C装置用于吸收少量的SO2,发生反应的离子方程式为______。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
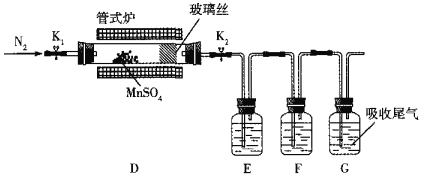
①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com