
【题目】1943 年,爱国实业家侯德榜发明了“联合制碱法”,以下是联合制碱法的简单流程:

(1)纯碱固体是______(填“离子”、“分子”或“原子”)晶体。组成该物质的元素原子的半径从大到小依次为______________________。
(2)写出反应(1)的化学反应方程式_____________________。
(3)操作 X 的名称________。
(4)产品 A 的化学式是________,由溶液 B 得到产品 A,需要在溶液 B 中通入 NH3、冷冻、加食盐,其中通入 NH3 的作用是______________________;
(5)工业生产的纯碱常会含少量 NaCl 杂质。现用重量法测定其纯度,步骤如下:
①称取样品 a(g),加水溶解;
②加入足量的 BaCl2 溶液;
③过滤、_______、烘干、_______、称量。
④____________,最终得到固体 b(g)。
补全上述实验步骤;样品中纯碱的质量分数为_____________(用含 a、b 的代数式表示)。
【答案】 离子 Na>C>O CO2+H2O+NaCl+NH3→ NaHCO3↓+NH4Cl 过滤 NH4Cl 增大 NH4+ 的浓度,使 NH4Cl 更多地析出;使 NaHCO3 转化为溶解度更大的 Na2CO3,提高析出的 NH4Cl纯度 洗涤 冷却 恒重操作 ![]()
【解析】(1)纯碱是碳酸钠,其固体是离子晶体。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则组成该物质的元素原子的半径从大到小依次为Na>C>O。(2)反应(1)生成碳酸氢钠和氯化铵,反应的化学反应方程式为CO2+H2O+NaCl+NH3→NaHCO3↓+NH4Cl。(3)将固体和溶液分离的操作名称是过滤。(4)过滤后得到碳酸氢钠,溶液中含有氯化铵。处理后得到NH4Cl;由溶液 B 得到产品 A,氨气溶于水显碱性,则通入NH3的作用是增大NH4+的浓度,使NH4Cl更多地析出;其次使NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl纯度;(5)③过滤后需要洗涤,烘干后需要冷却,最后称量。④恒重操作最终得到固体 b(g),即碳酸钡是bg,所以样品中纯碱的质量分数为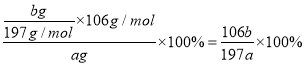 。
。


科目:高中化学 来源: 题型:
【题目】海水提溴一般需要经过浓缩、氧化和提取三个步骤。下列对操作步骤描述错误的是
A. 浓缩的原理是蒸发结晶 B. 氧化时通入氯气
C. 提取时利用Br2易挥发 D. 提取时用CCl4萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的FeO、Fe、Fe2O3的混合物中加入100 mL 1mol/L盐酸,恰好使混合物完全溶解,放出112 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为
A. 2.8g B. 5.6g C. 8.4g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 该烃属于苯的同系物
B. 分子中最多有6个碳原子处于同一直线上
C. 该烃的一氯代物有4种
D. 分子中最多有10个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯对花香和果香的香气有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。
(1)A结构简式为____________;B的官能团名称为________________;
(2)反应③的化学方程式为______________________________;
(3)D有很多同分异构体,苯环上只有一个取代基且属于酯类化合物的同分异构体共5个,已知其中3个的结构简式是:

请写出另外两个同分异构体的结构简式________________、___________________;
(4)C的同分异构体E,能与浓溴水反应生成白色沉淀,其核磁共振氢谱有4组吸收峰,E的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法中正确的是( )
A. 18O2中含18个中子B. 18O2与16O2性质完全相同
C. N5和N2互为同位素D. 2N5===5N2是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为____________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_____________。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式__________________________。
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数数K=____________。
氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4-的电子式 ____________。
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构____________(填“相同”或“不相同”)。
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式_____________。
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的蒸气密度是相同状况下甲烷密度的5.375倍。把8.6g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱石灰,碱石灰增重31g,又知生成H2O和CO2的物质的量比为1:1,试求此有机物A的分子式___________。有机物A的结构有多种:
(l)其中能与金属钠反应放出氢气的链状化合物( 结构不稳定)的数目有___个(不考虑立体异构)。
结构不稳定)的数目有___个(不考虑立体异构)。
(2)若有机物A的红外光谱和核磁共振氢谱谱图分别如下:

试确定A 的结构简式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com