
某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是 ( )
A.NH4+、Na+、Ba2+、Cl- B.Na+、I-、HCO3-、SO42-
C.K+、Cl-、SO32-、AlO2- D.Na+、Mg2+、SO42-、Cl-
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源:2015届广东省七校高三上学期第一次联考理综化学试卷(解析版) 题型:填空题
(16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H=b KJ/mol (Ⅱ)
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。
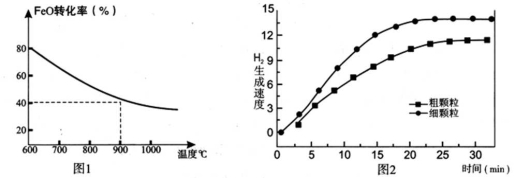
(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
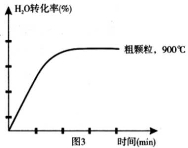
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
下列离子方程式中书写正确的是
A.氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+
B.碳酸氢钠溶液中加入少量的石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D.将饱和FeCl3溶液滴入沸水中:Fe3++3H2O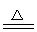 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:填空题
(10分)某澄清溶液,可能含有NH4+、Mg2+、Al3+、Na+、Cu2+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
①在试管中取少许溶液,滴加几滴石蕊试液,溶液呈红色。
②另取原溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫红色。
③向②所得水溶液中加入AgNO3溶液,有白色沉淀生成。
④另取原溶液,滴加NaOH溶液,得白色沉淀;继续加入NaOH溶液至过量,沉淀部分溶解,过滤后给滤液加热,有刺激性气味的气体产生。
(1)由此判断原溶液中一定有大量的 离子。
(2)步骤②反应的离子方程式是________________________________
(3)步骤④中沉淀溶解的离子方程式是
(4)还不能确定的阳离子是 ,如何检验?(写出实验名称及判断依据的现象)
____________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
对于4℃时100mL水中溶解了22.4 L HCl气体(标准状况下测得)后形成的溶液,下列说法中正确的是
A.该溶液物质的量浓度为10moL/L
B.所得的溶液的体积为22.5L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸式盐的水溶液一定显酸性
B.酸性氧化物一定是非金属氧化物
C.丁达尔效应是溶液和胶体的本质区别
D.HClO是弱酸,但NaClO是强电解质
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:实验题
(8分)化学是一门以实验为基础的科学,化学实验是化学学习的重要内容。
(1)根据你掌握的知识,下列描述正确的是 (填序号)
①将0.2mo1·L-1FeC13溶液滴加沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体;
②将95g蒸馏水倒入盛有5g氯化钠的200ml的烧杯中,搅拌溶解,配制5%的食盐水;
③实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
④使用容量瓶,滴定管、分液漏斗时,首先应检验仪器是否漏水;
⑤向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,加盐酸沉淀不消失,则原溶液中一定含有SO42-。
(2)实验室中需要480ml0.4mo1·L-1CuSO4溶液,应称取硫酸铜晶体(CuSO4·5H2O)的质量是 g;所用仪器除托盘天平(带砝码)、量筒、烧杯、玻璃棒、药匙外,还缺少的玻璃仪器是 ;在观察液面定容时,若俯视刻度线,会使所配制的溶液的浓度 ;(填“偏高、偏低或无影响”下同)转移溶液前容量瓶内有少量蒸馏水 ;
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:实验题
(10分)某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
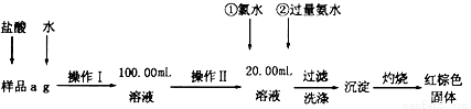
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 (填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为 ;
(3)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关实验的做法错误的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体
C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl-
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com