
 (1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu
(1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu分析 (1)电解质是指:在水溶液中或熔融状态下能够导电的化合物;强电解质是在水溶液中或熔融状态下,能完全电离的电解质;包括强酸、强碱、活泼金属氧化物和大部分盐;弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
(2)①醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离,由此分析解答;
②从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
解答 解:(1)①NH3属于非电解质;②SO3属于非电解质;③Cl2是单质;④BaSO4属于强电解质;⑤酒精 属于非电解质; ⑥CH3COONH4属于强电解质;⑦HClO弱电解质;⑧Cu是单质,所以属于非电解质的是①②⑤;属于强电解质的是④⑥;
(2)①醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.加入少量0.10mol•L-1CH3COOH,电离程度不变,故错误;
c.加水稀释至0.010mol•L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量醋酸钠固体,平衡逆向移动,则醋酸的电离程度降低,故错误;
f.加入少量0.10mol•L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故选:cf;
②由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
点评 本题考查了弱电解质的电离平衡,学生要弱电解质电离的特点分析解答,题目难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质用于制作光导纤维 | |
| B. | Al2O3熔点很高,可用作耐火材料 | |
| C. | SO2可以用来漂白面条 | |
| D. | N2与O2在放电条件下直接化合生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

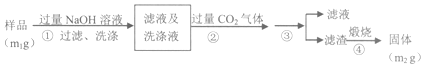
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 | 试纸先变红色后褪色 | 浓硝酸有酸性和氧化性 |
| B | CO2通入BaCl2溶液中 | 有白色沉淀出现 | 生成了BaCO3沉淀 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
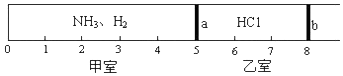
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 往溶液中加入盐酸,若放出能使澄清石灰水变浑浊的无色无味气体,则原溶液中只含CO32- | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3 和NaCl | B. | KCl和NaNO3 | C. | NaCl 和MgCl2 | D. | NaCl 和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用植物油属于人体所需的三大营养物质之一 | |
| B. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| C. | 淀粉、蛋白质、葡萄糖都是高分子化合物 | |
| D. | 甲烷、汽油、生物柴油、酒精都是碳氢化合物,均可作为燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com