
 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )| A. | 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大 | |
| B. | 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性 | |
| C. | 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)>c(A-)>c(H+)>c(OH-) | |
| D. | 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB |
分析 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释相同倍数时,酸性强的酸的pH的变化大,酸性较弱的酸的pH的变化小,据此得出酸性:HA>HB,且HB为弱电解质,
A.当氢氧化钠过量后,随着氢氧化钠的加入,水的电离程度逐渐减小;
B.若碱为弱碱,且其电离程度小于HB,混合液也可能呈碱性;
C.该关系中正电荷浓度大于负电荷,违反了电荷守恒;
D.HB的酸性较弱,则HB的浓度较大,则HB溶液消耗氢氧化钠溶液的体积较大.
解答 解:常温下,等体积、pH均为3的HA和HB溶液分别加水稀释相同倍数时,酸性强的酸的pH的变化大,酸性较弱的酸的pH的变化小,据此得出酸性:HA>HB,且HB为弱电解质,
A.向HB溶液中滴加NaOH溶液的过程中,在没有完全反应前水的电离程度一直增大,但NaOH过量后,随着NaOH的加入,水的电离程度逐渐减小,故A错误;
B.用pH为11的某碱与pH为3的HB溶液等体积混合后,若碱为弱电解质,且其电离程度比HB还弱,混合液可能显碱性,故B错误;
C.c(NH4+)>c(A-)>c(H+)>c(OH-)中正电荷浓度大于负电荷,不满足电荷守恒,不可能存在该离子浓度关系,故C错误;
D.已知酸性HA>HB,pH相等时HB溶液的浓度较大,完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB,故D正确;
故选D.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,正确判断HB、HA的酸性强弱为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及综合应用能力.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3O4 | B. | FeO | C. | Fe2O3 | D. | Fe5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
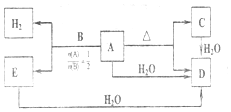
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原氨水物质的量浓度为0.1mol•L-1 | |
| B. | 反应后的溶液中c(NH+4)+c (NH3•H2O)+c(NH3)=0.1mol•L-1 | |
| C. | 反应后的溶液中:c(Cl-)>c(NH+4)>c(H+)>c( OH-) | |
| D. | 原氨水中:c(NH+4)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,C和D反应生成的化合物的电子式是
,C和D反应生成的化合物的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,向1LpH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出137.0kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表明的铜锈 | |
| C. | 服用阿司匹林出现水杨酸反应时,用NaOH溶液解毒 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com