
| 消耗量 |
| 起始量 |
| 消耗量 |
| 起始量 |
| 0.5mol |
| 2.5mol |


科目:高中化学 来源: 题型:
| A、直径介于1nm~100nm之间的微粒称为胶体 |
| B、电泳现象可证明胶体带电 |
| C、可用丁达尔效应来区分溶液和胶体 |
| D、刚含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L?min) |
| B、反应开始至2分钟时,A的转化率为10% |
| C、若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0 |
D、若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
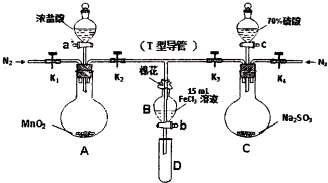
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有Fe2+ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有SO42- |
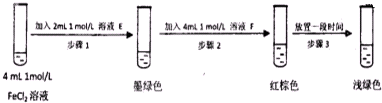
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m值等于3 |
| B、平衡时,体系中c(A):c(B):c(C)=4:9:8 |
| C、A的转化率为40% |
| D、用B表示该反应的平均反应速率为0.08mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40% | B、50% |
| C、80% | D、90% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com