
【题目】用铅蓄电池进行电絮凝净水是水净化方面的一项研究课题,其工作原理如图所示,下列叙述正确的是( )

A.Y的电极反应:PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B.铅蓄电池工作时H+向X极移动
C.电解池的总反应本质为电解水
D.每消耗103.5gPb,理论上电解池阴极上有11.2LH2生成
【答案】A
【解析】
在电解池的铁电极,发生反应2H2O+2e-=2OH-+H2↑,则铁电极为阴极,铝电极为阳极,从而得出Y电极为正极,X电极为负极。
A.Y为正极,PbO2得电子生成的Pb2+与SO42-结合成PbSO4,氧元素与H+结合成H2O,电极反应为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,A正确;
B.铅蓄电池工作时X极为负极,H+向正极(Y)移动,B不正确;
C.电解池的总反应本质为2Al+6H2O![]() 2Al(OH)3+3H2↑,C不正确;
2Al(OH)3+3H2↑,C不正确;
D.每消耗103.5gPb,转移电子![]() =1mol,理论上电解池阴极上生成0.5molH2,由于未指明是否为标准状况,其体积不一定是11.2L,D不正确;
=1mol,理论上电解池阴极上生成0.5molH2,由于未指明是否为标准状况,其体积不一定是11.2L,D不正确;
故选A。


科目:高中化学 来源: 题型:
【题目】锡酸钠(Na2SnO3)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,一种由锡精矿制备锡酸钠的工艺流程如图:
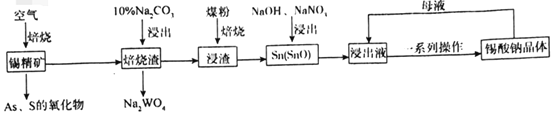
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②锡酸钠易溶于水,其溶解度随着温度的升高而降低。
请回答下列问题:
(1)Na2SnO3中锡元素的化合价为___,从焙烧渣中除去Fe3O4最简单的方法为___。
(2)WO3与Na2CO3溶液反应生成Na2WO4的化学方程式为___。
(3)加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___。
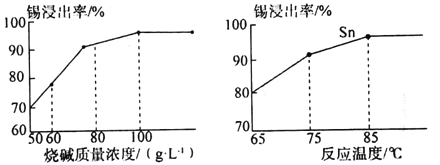
(4)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH的质量浓度和反应时间的关系图,则“碱浸”时最适宜条件为___、___。
(5)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___,将母液返回至浸出液的目的为___。
(6)碱性镀锡以NaOH和Na2SnO3为电解液,以纯锡为阳极材料,待镀金属为阴极材料,镀锡时阳极反应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16mol 充入 10L 恒容密闭容器中,恒容器闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11. | 0.10 | 0.10 |
A.反应前 2min 的平均速率 v(Z)=2.0×10-3mol·L-1min-1
B.其他条件不变,向平衡体系中再充入0.16mol 气体 X,与原平衡相比,达到新平衡时,气体 Y 的转化率增大,X 的体积分数增大,Z 的体积分数减少
C.其他条件不变,降低温度,反应达到新平衡前 v (逆)>v(正)
D.保持其他条件不变,起始时向溶液中充入0.32mol气体X 和0.32mol 气体 Y,到达平衡时,n(Z)<0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烯是一种重要的有机化工原料,某化学小组利用如图装置制备氯乙烯,下列有关说法错误的是
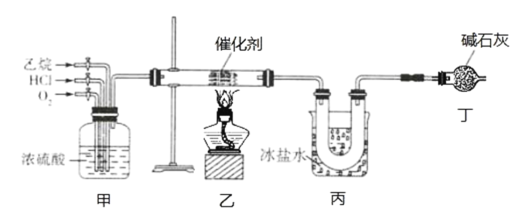
A.装置乙中发生反应的化学方程式为:CH3CH3+HCl+O2![]() CH2=CHCl+2H2O
CH2=CHCl+2H2O
B.装置甲可通过控制通入气体的速率来控制反应气体的物质的量之比
C.装置丙的主要作用为冷凝并分离出氯乙烯
D.装置丁可以完全吸收尾气,实现尾气零排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期第ⅥA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=akJ·mol-1
2Se(s)+2H2O(l) ΔH1=akJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=bkJ·mol-1
2H2O(l) ΔH2=bkJ·mol-1
反应H2(g)+Se(s)![]() H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是__(填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:_。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
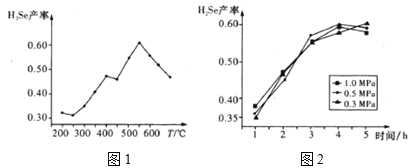
则制备H2Se的最佳温度和压强为__。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈__(填“酸性”或“碱性”),请通过计算数据说明__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题
将一定比例的三氧化硫和水混合可制得硫酸。硫酸是一种重要的化工原料,用途十分广泛,除用于化学工业外,还非常广泛应用于肥料、非碱性清洁剂、护肤品、油漆添加剂与炸药的制造等方面。
【1】关于浓硫酸的说法正确的是
A.易挥发
B.见光分解
C.密度比水的小
D.常温下能使铝片钝化,浓硫酸作氧化剂
【2】稀硫酸可以用于实验室制氢气,反应方程式为Zn+H2SO4=ZnSO4+H2↑,该反应的反应类型说法正确的是
A.化合反应B.复分解反应C.置换反应D.分解反应
【3】在其他条件不变的情况下,欲提高硫酸与锌反应产生氢气的速率,可以采用的措施有
A.选用颗粒更大的锌粒
B.升高反应温度
C.用98%浓硫酸来代替稀硫酸反应
D.加入硫酸钾溶液
【4】下列反应中,生成物总能量高于反应物总能量的是
A.S+O2![]() SO2
SO2
B.CaO+H2O=Ca(OH)2
C.C+CO2![]() 2CO
2CO
D.Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵(NH4Fe(SO4)2·xH2O)是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:

(1)步骤②需要加热的目的是_______________
(2)步骤②温度保持80-95℃,采用的合适加热方式是_____________________
(3)步骤③加入5%H2O2的目的是将Fe2+全部氧化为Fe3+,不引入杂质,请写出反应的离子方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钙[Ca(IO3)2]是重要的食品添加剂。实验室制取Ca(IO3)2·H2O的实验流程:
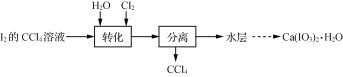
已知:碘酸是易溶于水的强酸,不溶于有机溶剂。
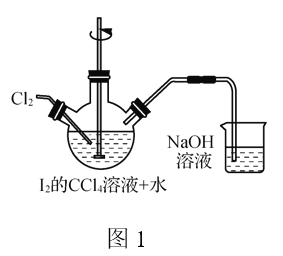
(1) 转化步骤是为了制得碘酸,该过程在图1所示的装置中进行,当观察到反应液中紫红色接近褪去时,停止通入氯气。
①转化时发生反应的离子方程式为_____________________________________。
②转化过程中CCl4的作用是_______________________________________。
③为增大转化过程的反应速率,可采取的措施是_______________________。
(2)将CCl4与水层分离的玻璃仪器有烧杯、________。除去HIO3水溶液中少量I2单质的实验操作为______________________________,直至用淀粉溶液检验不出碘单质的存在。
(3)已知:①Ca(IO3)2·6H2O是一种难溶于水的白色固体,在碱性条件下不稳定。
②Ca(IO3)2·6H2O加热升温过程中固体的质量变化如图2所示。
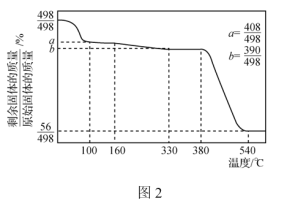
设计以除碘后的水层为原料,制取Ca(IO3)2·H2O的实验方案:向水层中__________。[实验中必须使用的试剂:Ca(OH)2粉末、AgNO3溶液]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与原因对应关系不正确的是
A | B | C | D | |
物质 |
Na2FeO4 |
海水稻 |
金属铜 |
碳酸钠 |
事实 | 用于自来水净水消毒 | 海水稻的秸杆可以燃烧发电 | Cu作原电池的电极 | 制革工业中原料皮的脱脂 |
主要原因 | Na2FeO4有强氧化性且能在水中产生胶体 | 稻子的秸杆中蕴含生物质能 | Cu能导电且质稳定 | Na2CO3稳定性强 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com