
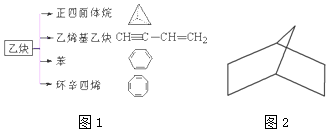
分析 (1)依据烷烃中碳原子的成键方式判断碳原子和氢原子的个数;依据正四面烷中不同环境下的氢原子的种数判断二氯代物的种数;
(2)a.碳碳三键、碳碳双键能被酸性酸性KMnO4溶液氧化;
b.碳碳三键与Br21:2加成,碳碳双键与Br21:1加成;
c.乙烯基乙炔的官能团是碳三键、碳碳双键;
d.乙炔与乙烯基乙炔的最简式相同;
(3)每个折点和线端点处表示有一个碳原子,并以氢补足四价,可得分子式;等效氢原子数有几种,一氯代物就有几种同分异构体.
解答 解:(1)正四面体烷中有4个碳原子,4个氢原子,所以其分子式为C4H4,正四面体烷中4个氢原子完全等效,所以其二氯代物只有1种,
故答案为:C4H4;1;
(2)a.碳碳三键、碳碳双键能被酸性酸性KMnO4溶液氧化,所以乙烯基乙炔能使酸性KMnO4溶液褪色,故a正确;
b.1mol乙烯基乙炔分子中1mol碳碳双键、1mol碳碳三键,1mol碳碳双键能和1摩尔Br2发生加成反应,1mol碳碳三键能和2摩尔Br2发生加成反应,所以1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应,故b正确;
c.乙烯基乙炔的官能团是碳三键、碳碳双键,因此乙烯基乙炔分子内含有两种官能团,故c正确;
d.乙炔与乙烯基乙炔的最简式相同,因此等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同,故d错误;
故答案为:d;
(3)由键线式可知其分子中含有7个碳原子、12个氢原子,则分子式为为C7H12;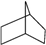 的结构对称,分子中含3种位置的H,则一氯取代时,取代位置有3种,
的结构对称,分子中含3种位置的H,则一氯取代时,取代位置有3种,
故答案为:C7H12;3.
点评 本题考查有机物的结构与性质、同分异构体数目的判断,难度中等,为高频考点,掌握官能团和性质的关系是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol O2 与1mol 纯碱的体积相同 | |
| B. | 常温常压下,18g H2O所含的氧原子的数目为NA | |
| C. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| D. | 1L 水溶解58.5g NaCl 所形成的溶液的物质的量浓度是0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的原子数为NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为3NA | |
| D. | 0.1 molNa+中所含的电子为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子 | |
| B. | 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA | |
| C. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3molCO2中含有氧原子数0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
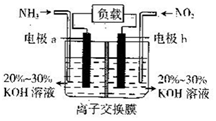 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )| A. | 电流从电极a经过负载后流向电极b | |
| B. | 为使电池持续放电,离子交换膜只允许阴离子通过 | |
| C. | 电极a的电极反应式为2NH3-6e-=N2+6H- | |
| D. | 室温下,当有4.48 L NO2被处理时,转移电子为0.8 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com