
【题目】(1)有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2moI·L-1,c(Cl-)为1.3mol·L-1,要使Mg2+完全转化为沉淀分离出来,至少需要加4mol·L-1 NaOH溶液的体积为___mL。
(2)某溶液中只含有Na+,Al3+,Cl-,SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为___。
(3)5.85gNaCl和xgMgCl2一起溶于水配成1L溶液,测得Cl-物质的量浓度为0.3mol·L-1,则x的值为___g。
【答案】80 1:2 9.5
【解析】
(1)根据MgCl2和AlCl3的混合溶液与碱的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+恰好转化为AlO2-,先利用电荷守恒来计算Al3+的浓度,再根据反应方程式计算即可;
(2)根据电荷守恒分析;
(3)根据Cl-的物质的量找出物质之间的关系,再根据n=![]() 解答。
解答。
(1)MgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.2molL1,Cl浓度为1.3molL1,
设Al3+的浓度为x,由电荷守恒可知,
0.2mol/L×2+x×3=1.3mol/L×1,
解得x=0.3mol/L,
则Mg2+、Al3+的物质的量分别为0.2L×0.2mol/L=0.04mol、0.2L×0.3mol/L=0.06mol,
发生的反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl
1 2
0.04mol 0.08mol
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
1 4
0.06mol 0.24mol
使Mg2+全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.08mol+0.24mol=0.32mol,
则需加4molL1NaOH溶液的体积为![]() =0.08L=80mL,故答案为:80mL;
=0.08L=80mL,故答案为:80mL;
(2)溶液中阳离子所带正电荷总数和阴离子所带负电荷总数相等,即n(Na+)+3n(Al3+)=n(Cl-)+2n(SO42-),因Na+、Al3+、Cl-个数比为3:2:1,设分别为3a、2a和a个,则可以计算SO42-的个数为4a,故溶液中Al3+和SO42-的离子个数比2a:4a=1:2,故答案为:1:2;
(3)5.85g NaCl的物质的量是![]() ,而溶液中Cl-的物质的量为
,而溶液中Cl-的物质的量为 ![]() ,所以x g的MgCl2中所含的Cl-的物质的量是0.3mol-0.1mol=0.2mol,即MgCl2的物质的量是0.1mol,
,所以x g的MgCl2中所含的Cl-的物质的量是0.3mol-0.1mol=0.2mol,即MgCl2的物质的量是0.1mol,![]() ,故答案为:9.5。
,故答案为:9.5。


科目:高中化学 来源: 题型:
【题目】某学习小组利用酸性KMnO4和H2C2O4反应来探究“外界条件对化学反应速率的影响”。 实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)已知草酸H2C2O4是一种二元弱酸,写出草酸的电离方程式______________、_____________。
某同学设计了如下实验:
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究浓度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
(3)实验a测得混合后溶液褪色的时间为40s,忽略混合前后体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______ mol·L-1·min-1。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快,褪色速率后来加快的原因可能是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____________________。
(3)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是___________________________________。
某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由____________________________________。
(4)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃、101 KPa下:
①H2(g)+1/2O2(g)===H2O(g) ΔH1=-242 kJ/mol
②CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g)
ΔH2=-676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,11.2L CH4与H2的混合气体恰好与11.2L O2完全反应生成CO2和H2O,则原混合气体中的平均相对分子质量为( )
A. 5.56B. 6.67C. 11.12D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了利用氯酸钾分解制O2测定标准状况下气体摩尔体积的探究实验。
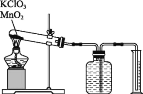
实验步骤如下:①连接好实验装置,检查装置的气密性。②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95g。③加热,开始反应,直到不再有气体产生为止。④测量排入量筒中水的体积为285.0mL,换算成标准状况下氧气的体积为279.7mL。⑤准确称量试管和残留物的质量为15.55g。根据上述实验过程,回答下列问题。
(1)如何检查装置的气密性?________。
(2)以下是测量收集到的气体体积必须包括的几个步骤:①使试管和广口瓶内气体都冷却至室温;②_____;③读取量筒内液体的体积。进行③的实验操作时,若仰视读数,则读取氧气的体积__ (填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是______mol;实验测得标准状况下氧气的摩尔体积是__ (保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. 氯化氢的电子式:![]() B. 镁的原子结构示意图:
B. 镁的原子结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 碳酸钠的电离方程式:Na2CO3=Na++CO32一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析不正确的是
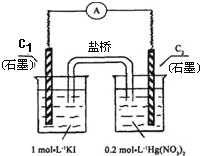
A. 如图装置的电流方向是从C2到C1
B. C1附近加入淀粉变蓝,C2析出固体
C. 可用饱和KI溶液—琼脂填充盐桥增强导电性
D. 该装置内发生的氧化还原反应可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com