
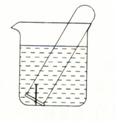
 图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:
图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:分析 (1)根据试管内液面上升,说明试管中气体减少,则发生了吸氧腐蚀,Fe作负极失电子,O2作正极得电子生成氢氧根离子;
(2)根据试管内液面下降,说明试管中气体增加,则发生了析氢腐蚀,正极上氢离子得电子生成氢气.
解答 解:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,
(1)若试管内液面上升,说明试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,
故答案为:吸氧;2H2O+O2+4e-=4OH-.
(2)若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:析氢;Fe-2e-=Fe2+;2H++2e-=H2↑.
点评 本题考查了钢铁的电化学腐蚀,注意酸性条件下,钢铁发生析氢腐蚀,弱酸性或中性条件下,钢铁发生吸氧腐蚀,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸具有脱水性 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠存放于煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子半径 | 酸性 |
| Na+< O2- | H2SO4<HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 钠 | 钾 | 钠钾合金(质量比1:3) | |
| 熔点/℃ | 97.9 | 63.5 | <-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | B. | 负极的电极反应式为:Pb-2e-=Pb2+ | ||
| C. | Pb得电子,发生氧化反应 | D. | 电池充电时,溶液酸性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com