
| A. | ①③ | B. | ②④ | C. | ③⑥ | D. | ⑤⑥ |
分析 ①第二主族元素的单质都是金属,其失电子能力与金属性成正比;
②元素的最高正化合价在数值上等于它所在的族序数,但O、F元素和副族除外;
③元素的金属性越强,其失电子能力越强,且同一周期元素,元素金属性、原子半径随着原子序数增大而减小;
④元素的非金属性越强,它的最高价氧化物的水化物酸性越强;
⑤元素的非金属性越强,其简单阴离子还原性越弱;
⑥元素的非金属性越强,它的最高价氧化物的水化物酸性越强.
解答 解:①第二主族元素的单质都是金属,其失电子能力与金属性成正比,同一主族元素其金属性随着原子序数增大而增强,所以第二主族元素的单质从上到下,失电子能力增强,故错误;
②元素的最高正化合价在数值上等于它所在的族序数,但O、F元素和副族除外,主族元素最高化合价与其族序数相等但O、F元素除外,故错误;
③元素的金属性越强,其失电子能力越强,且同一周期元素,元素金属性、原子半径随着原子序数增大而减小,所以同周期主族元素的原子半径越小,越难失去电子,故正确;
④元素的非金属性越强,它的最高价氧化物的水化物酸性越强,而它的气态氢化物水溶液的酸性没有此递变规律,若是同主族元素,元素的非金属性越强,它的气态氢化物水溶液的酸性越弱,故错误;
⑤元素的非金属性越强,其简单阴离子还原性越弱,非金属性Cl>Br>S,所以简单阴离子还原性:S2->Br-
>Cl-,故错误;
⑥元素的非金属性越强,它的最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故正确;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一主族、同一周期原子结构与元素周期律的关系是解本题关键,注意规律中的反常现象,易错选项是②.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 | |
| B. | 转移到容量瓶过程中,有少量溶液溅出 | |
| C. | 转移后未洗涤小烧杯和玻璃棒 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol H2(g)和1 mol I2(g) | B. | 3 mol HI(g) | ||
| C. | 2 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
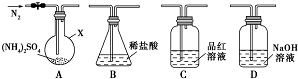
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O.
;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将盐酸和醋酸钠溶液混合后溶液至中性,溶液中c(Na+)=c(Cl-) | |
| B. | 1 mol CH4分子中含有的共价键数目等于1 mol Na2O2固体中含有的离子总数 | |
| C. | 80℃的纯水的pH大于25℃的纯水的pH | |
| D. | 等体积、等pH的盐酸和醋酸与1mol/L的NaOH溶液完全中和,消耗的NaOH溶液体积后者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com