
| A. | 锂单质可保存在煤油中 | |
| B. | 锂单质能与盐酸剧烈作用,并有气体产生 | |
| C. | LiOH的碱性比NaOH的碱性强 | |
| D. | Li+半径比Na+半径大 |
分析 A、锂是最轻的金属单质;
B、锂的金属活泼性仅次于钠;
C、金属性越强,所对应的最高价氧化物的水化物的碱性越强;
D、电子层数越多,原子半径越大.
解答 解:A、锂是最轻的金属单质,密度比煤油小,故不能保存在煤油中,要保存在石蜡油中,故A错误;
B、锂的金属活泼性仅次于钠,和盐酸剧烈反应生成LiCl和氢气,故B正确;
C、金属性越强,所对应的最高价氧化物的水化物的碱性越强,由于金属性Na强于Li,故NaOH的碱性强于LiOH,故C错误;
D、电子层数越多,原子半径越大,Li+的核外有1个电子层,而Na+的核外有2个电子层,故Na+的半径更大,故D错误.
故选B.
点评 本题考查了碱金属单质性质的相似性和递变性,应注意的是锂不能保存在煤油中,要保存在石蜡油中.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 2NH4Cl+Ba(OH)2•10H2O═BaCl2+2NH3↑+12H2O△H>0 | |
| B. | Fe3++3SCN-?Fe(SCN)3 △H<0 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0 | |
| D. | CaO+H2O═Ca(OH)2 △H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生白色沉淀,继而沉淀溶解 | B. | 只放出气体 | ||
| C. | 生成白色沉淀,且不消失 | D. | 既生成白色沉淀又放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所占的体积一定相等 | B. | 所含原子总数相等 | ||
| C. | 所含电子总数相等 | D. | 所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| n(CO2)mol | 2 | 3 | 4 | 6 |
| n(沉淀) mol | 1 | 2 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
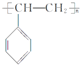 生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )
生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其结构简式如图所示.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com