
 HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-����C��ȷ��
HCO3-+OH-����C��ȷ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��ʾ14Cԭ�ӽṹʾ��ͼ ��ʾ14Cԭ�ӽṹʾ��ͼ | B�� ��ʾCCl4���ӵı���ģ�� ��ʾCCl4���ӵı���ģ�� | C��HClO�Ľṹʽ��H-Cl-O | D��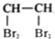 ��ʾ1��1��2��2-�������� ��ʾ1��1��2��2-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.��������������Һ��̼��������Һ��ϣ�OH-+![]() ====H2O+
====H2O+![]()
B.����ˮ������ӷ���ʽ��Al3++3H2O====Al(OH)3��+3H+
C.������ʴʱ���ܷ�����������Ӧ��2H2O+O2+4e-====4OH-
D.��ʾ����ȼ�յ��Ȼ�ѧ����ʽ��2H2��g��+O2(g)====2H2O(1);��H=+571.6 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ����9��������⻯ѧ�Ծ� ���ͣ�ѡ����
��ѧ������ѧϰ��ѧ����Ҫ���ߣ�����������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ����
A������ȼ�ϵ�صĸ�����Ӧʽ��O2 + 2H2O + 4e-��4OH��
B����ⱥ��ʳ��ˮʱ�������ĵ缫��ӦʽΪ��2Cl����Cl2��+2e-
C����ͭ����ʱ�����Դ�����������Ǵ�ͭ���缫��ӦʽΪ��Cu��Cu2+ +2e-
D�����������绯ѧ��ʴ��������Ӧʽ��Fe��Fe2++2e-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���㽭ʡ�����߿�ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ�ѡ����
��ѧ������ѧϰ��ѧ����Ҫ���ߣ�����������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ����
A.������ʴʱ���ܷ����ķ�Ӧ(����)��2H2O+O2��4e��=4OH��
B.1 L��0.5 mol/Lϡ������1 L��1 mol/LNaOH��Һ��Ӧ�ų�57.3kJ���ȣ������к��ȵ��Ȼ�ѧ����ʽ��H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)����H= ��114.6 kJ/mol
C.̼��������Һ����������ʯ��ˮ��Ӧ��HCO3��+Ca2++OH��=CaCO3��+H2O
D.�������������ɱ��������ܽ⣺2Fe(OH)3��6H����2Br����2Fe2����Br2��6H2O[��Դ:]
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com