
| A. | 2 | B. | 3 | C. | 8 | D. | 18 |
科目:高中化学 来源: 题型:选择题
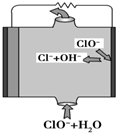 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )| A. | 放电过程中OH-移向正极 | |
| B. | 电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- | |
| C. | 镁燃料电池中镁均为负极,发生氧化反应 | |
| D. | 镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
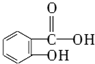 ,俗名水杨酸.
,俗名水杨酸. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
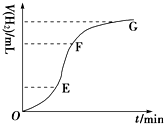 现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:
现欲用纯净的锌粒与稀盐酸反应制取H2,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
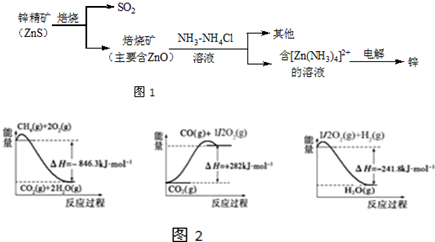
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | KNO3 | C. | HCl | D. | CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
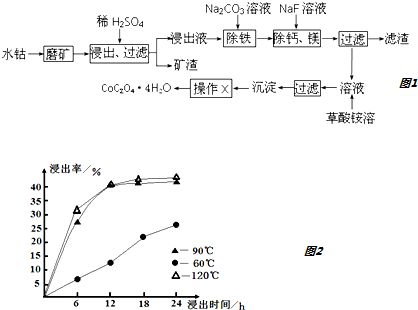
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com