
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 mol·L-1 |
| H2CO3 | K1=4.3×10-7 mol·L-1 |
| K2=5.6×10-11 mol·L-1 |
A.[HCO ]>[ClO-]>[OH-]
]>[ClO-]>[OH-]
B.[ClO-]>[HCO ]>[H+]
]>[H+]
C.[HClO]+[ClO-]=[HCO ]+[H2CO3]
]+[H2CO3]
D.[Na+]+[H+]=[HCO ]+[ClO-]+[OH-]
]+[ClO-]+[OH-]
科目:高中化学 来源: 题型:
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+。下列说法中正确的是
A.充电时的总反应为FePO4+Li=LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是H2A===H++HA-;HA-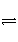

H++A2-。
回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)________________________________________________________________________。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能__________0.11 mol·L-1(填“>”、“=”或“<”),理由是
________________________________________________________________________
__________________。
(3)0.1 mol·L-1 NaHA的溶液中各种离子浓度由大到小的顺序是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,不正确的是( )
|
| A. | a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b |
|
| B. | 常温,CH3COONa溶液的pH=8,则c(Na+)﹣c(CH3COO﹣)=9.9×10﹣7mol/L |
|
| C. | 常温下,0.1mol/L的某酸溶液中,若c(OH﹣)/c(H+)=1×10﹣8,则溶液中由水电离出的c(H+)=1×10﹣11mol/L |
|
| D. | 在0.1mol/L的Na2SO3溶液中加入少量NaOH固体,c(SO32﹣)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡:CH3COOH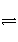
 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:[H+]=[OH-]+[CH3COO-]
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中[OH-]增大
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH,下列说法正确的是( )
A.浓度均为0.1 mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1 mol·L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中只含有Na+、F-、H+、OH-、H2O五种微粒
D.NaF溶液中加入少量NaOH固体,溶液中c(F-)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
一种澄清透明的溶液中,可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH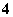 、Cl-、NO
、Cl-、NO 、HCO
、HCO 、SO
、SO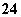 。现做以下实验:
。现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
(3)将(2)中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
(4)另取溶液,逐滴加入NaOH溶液至过量,只看到有红褐色沉淀生成,且沉淀质量不减少。
由此可以推断:
溶液中肯定存在的离子有_________________________________________________;
溶液中肯定不存在的离子有________________________________________________;
溶液中不能确定是否存在的离子有_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
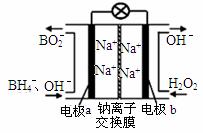 (1)据报道以硼氢化合物NaBH4(H的化合价为-1价)和H2O2作原料的燃料电池,可用作通信卫星电。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式:
(1)据报道以硼氢化合物NaBH4(H的化合价为-1价)和H2O2作原料的燃料电池,可用作通信卫星电。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式:
▲ 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。
已知: N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H = – 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H = – 98.6 kJ·mol—1
写出常温下,N2H4(l) 与 H2O2(l)反应生成N2和H2O的热化学方程式 ▲ 。
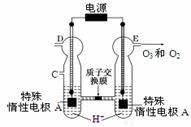 (3)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
(3)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
①图中阴极为 ▲ (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: ▲
(4)向一密闭容器中充入一定量一氧化碳跟水蒸气发生反应 CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是____ ▲ _____(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是____ ▲ _____(选填编号)。
A.v正(H2O) = v逆(H2)
B.容器中气体的压强不再发生改变
C.H2O的体积分数不再改变
D.容器中CO2和H2的物质的量之比不再发生改变
E.容器中气体的密度不再发生改变
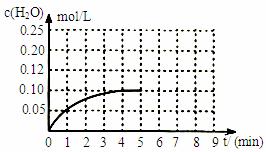 (5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g)
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com