
| A. | 褪色 | B. | 变成红色 | C. | 先褪色后变红 | D. | 先变红后褪色 |
科目:高中化学 来源: 题型:选择题
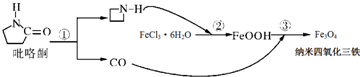
| A. | Fe3O4可以表示为FeO•Fe2O3,属于混合物 | |
| B. | 在反应②中FeCl3•6H2O被环丙胺(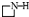 )还原为FeOOH )还原为FeOOH | |
| C. | 纳米四氧化三铁材料为胶体 | |
| D. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有电子得失或偏移 | B. | 氧化反应一定先于还原反应 | ||
| C. | 氧化剂发生氧化反应 | D. | 其实质是元素化合价发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
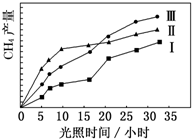 利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.
利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,10.6g Na2CO3含有的Na+离子数为0.2 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol•/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol NH5中含有5NA个N-H键(NA为阿伏加德罗常数) | |
| B. | NH5中既有共价键,又有离子键 | |
| C. | NH5的电子式为: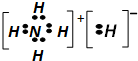 | |
| D. | 与水反应时,水作氧化剂,生成1mol氢气,转移2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com