
A、
| ||
B、
| ||
C、
| ||
D、
|
| 1 |
| 2 |
| n |
| V |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| (2b-a)mol | ||
|
| 2(2b-a) |
| V |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HI的生成速率与H2的生成速率相等 |
| B、H2的生成速率与I2的生成速率相等 |
| C、混合物的颜色不再发生变化 |
| D、H2、I2、HI的分子数之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、它们都是吸热反应 |
| B、a、b和c均为正值 |
| C、a<b |
| D、2b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+ |
| B、SO2 |
| C、H3O+ |
| D、OF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.20mol/L |
| B、0.30mol/L |
| C、0.40mol/L |
| D、0.60mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、①④⑤ |
| C、①②③ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
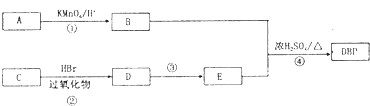 增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com