
分析 红土镍矿(主要成分为NiSO4,还含有杂质SiO2、Al2O3、Fe3O4)加入浓硝酸,其中Al2O3、Fe3O4酸溶解后,加碳酸钙调节PH值,三价铁离子先沉淀,浸出渣为SiO2和氢氧化铁(或FeOOH),浸出液中含镍离子、铝离子、钙离子、硝酸根,浸出液通过除铝,经过一系列处理最后得到产品Ni(NO3)2,据此答题.
(1)Fe3O4中含三价铁和二价铁,与浓硝酸发生氧化还原反应生成三价铁,浓硝酸被还原成二氧化氮;
(2)2.5mol/L的硫酸为稀硫酸,不能氧化二价铁离子,需要通入一种氧化性气体;
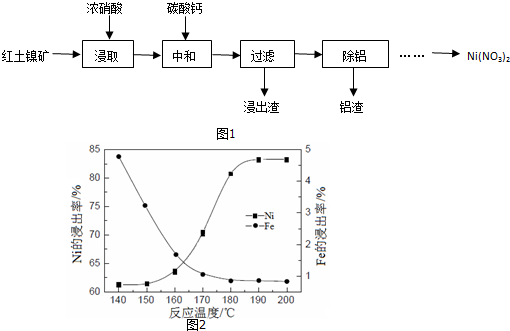
(3)要使浸出液中的镍的含量高,铁的含量低,根据图象选择;
(4)控制温度80℃、pH=4,则浸取液中的Fe3+会水解生成FeOOH,则水解的离子方程式为:Fe3++2H2O$\stackrel{80℃}{?}$FeOOH+3H+;
(5)实验室洗涤固体的操作方法是加水浸没沉淀,待水流出,重复2~3次;
(6)浓硝酸不稳定,易分解为氮氧化物,使吸收率下降.
解答 解:红土镍矿(主要成分为NiSO4,还含有杂质SiO2、Al2O3、Fe3O4)加入浓硝酸,其中Al2O3、Fe3O4酸溶解后,加碳酸钙调节PH值,三价铁离子先沉淀,浸出渣为SiO2和氢氧化铁(或FeOOH),浸出液中含镍离子、铝离子、钙离子、硝酸根,浸出液通过除铝,经过一系列处理最后得到产品Ni(NO3)2.
(1)Fe3O4中含三价铁和二价铁,与浓硝酸发生氧化还原反应生成三价铁,浓硝酸被还原成二氧化氮,离子方程式为:Fe3O4+10H++NO3-=3Fe3++NO2↑+5H2O,
故答案为:Fe3O4+10H++NO3-=3Fe3++NO2↑+5H2O;
(2)2.5mol/L的硫酸为稀硫酸,不能氧化二价铁离子,需要通入一种氧化性气体,常通入氧气,故答案为:O2;
(3)要使浸出液中的镍的含量高,铁的含量低,根据图象可知温度在190℃(或190~200℃之间某一温度、或某一区间)便达到目的,
故答案为:190℃(或190~200℃之间某一温度、或某一区间);
(4)控制温度80℃、pH=4,浸取液中Fe3+会水解生成FeOOH,则水解的离子方程式为:Fe3++2H2O$\stackrel{80℃}{?}$FeOOH+3H+,故答案为:Fe3++2H2O$\stackrel{80℃}{?}$FeOOH+3H+;
(5)实验室洗涤固体的操作方法是加水浸没沉淀,待水流出,重复2~3次,故答案为:加水浸没沉淀,待水流出,重复2~3次;
(6)浓硝酸不稳定,所以硝酸浓度达35%时,易分解为氮氧化物,使吸收率下降,故答案为:硝酸浓度达35%时,易分解为氮氧化物,使吸收率下降.
点评 本题考查了物质分离和制备流程的分析判断,属于高频考点,主要是实验基本操作、物质性质、离子方程式的书写,题目难度中等,培养学生解决实际问题的能力.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 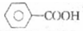 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 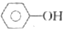 和 和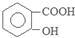 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
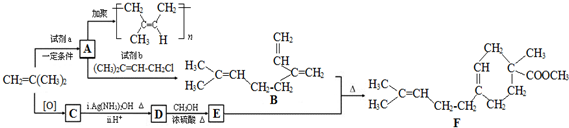
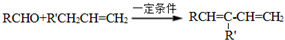
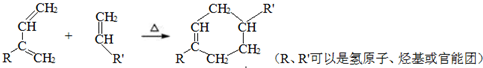
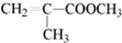 .
.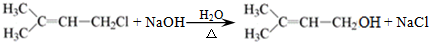 .
.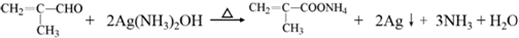 .
.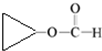 .
.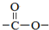 结构.
结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H+═2Fe3++3H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
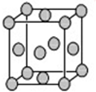 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题. .填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).
.填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).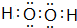 ,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.
,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.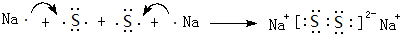 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol•L-1HF溶液中H+数目为NA,则等体积的2mol•L-1HF溶液中H+数目为2NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36g3H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
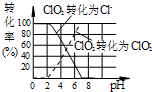 作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com