
 “粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.
“粤盐”精制盐的食品添加剂为KIO3、K4[Fe(CN)6](亚铁氰化钾);碘在科研与生活中有重要应用.| 实验 序号 | 体积V/mL | ||||
| KIO3溶液 | 水 | H2SO4溶液 | Na2SO3溶液 | 淀粉溶液 | |
| ① | 12.0 | 0.0 | 6.0 | 10.0 | 2.0 |
| ② | 10.0 | X | 6.0 | 10.0 | 2.0 |
| ③ | 11.0 | 1.0 | 6.0 | 10.0 | 2.0 |
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量精制盐样品于洁净试管中,加入适量蒸馏水 | 得到无色溶液 | |
| ② | 试样含有K+ | ||
| ③ |
| 5SO32- |
| SO32- |
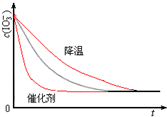 ,图中最上方为降低温度,最下方为使用催化剂,答:图象为
,图中最上方为降低温度,最下方为使用催化剂,答:图象为 .
.| ② | 将洁净的铂丝灼,烧蘸取①的溶液在无色火焰上灼烧 (透过蓝色钴玻璃观察) | 火焰呈紫色 | |
| ③ | 取少取①所得溶液于洁净试管中,加入FeCl3溶液 | 生成蓝色沉淀 | 试样含有[Fe(CN)6]4-,结合②则含有 K4[Fe(CN)6] |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、C2H6 |
| B、CH4、C3H8 |
| C、CH4、C3H6 |
| D、CH4、C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有糖类物质都有甜味,但不一定都溶于水 |
| B、葡萄糖和果糖性质不同,但分子式相同 |
| C、葡萄糖和蔗糖不是同分异构体,但属于同系物 |
| D、葡萄糖、果糖和蔗糖都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4,C4H8 |
| B、CH4,C4H10 |
| C、C2H4,C3H8 |
| D、C2H2,C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com