
| A. | ①②④⑦ | B. | ①②③④ | C. | ③⑤⑥⑦ | D. | ①②⑤⑥ |
分析 ①由两种或两种以上的物质组成,则属于混合物;
②冰是水,干冰为固体二氧化碳;
③能够再生的能源是可再生能源;
④根据常见的合金铁合金、铜合金等分析;
⑤盐酸和食醋都是溶液;
⑥纯碱是碳酸钠;
⑦豆浆和雾形成的分散系是胶体.
解答 解:①粗盐和酸雨都是由两种或两种以上的物质组成,则属于混合物,故①正确;
②冰是水,干冰为固体二氧化碳,都是由两种元素组成的纯净物,则属于化合物,故②正确;
③沼气是由发酵产生的,属于可再生能源,但水煤气是由煤和水高温反应的产物,则属于不可再生能源,故③错误;
④不锈钢是铁的合金,目前使用的硬币有铜镍合金和不锈钢,都属于合金,故④正确;
⑤盐酸和食醋都是溶液,属于化合物,它们中的溶质HCl和CH3COOH都是化合物,二者属于酸,故⑤错误;
⑥纯碱是碳酸钠,是由金属离子和酸根离子构成,属于盐,故⑥错误;
⑦豆浆和雾形成的分散系是胶体,故⑦正确;
故选A.
点评 本题考查常见物质的分类,明确物质的组成、构成以及分类标准即可解答,并注意物质的俗名、能源等知识来解,难度不大.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
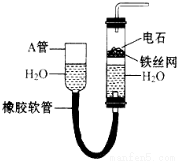 如图装置可以制取乙炔,请填空:
如图装置可以制取乙炔,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素水解产物中无葡萄糖 | |
| B. | 使用的硫酸过浓,只发生了脱水反应 | |
| C. | 由于水解后混合液中含有H2SO4,所以见不到红色沉淀 | |
| D. | 加热时间不够长,所以见不到红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应前后原子的种类和数目一定不变 | |
| B. | 反应前后分子的种类和数目一定改变 | |
| C. | 反应物的总能量E1与生成物的总能量E2一定相等 | |
| D. | 若此反应为放热反应,则E2>E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 可逆反应达到化学平衡状态时,正、逆反应速率都为0 | |
| C. | 决定反应速率的主要因素是反应物的性质 | |
| D. | 增大反应物浓度,提高反应温度都能增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com