
| A、100mL 1mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、100ml 1mol/L NaCl溶液 |
| D、200ml 0.5mol/L HCl溶液 |


科目:高中化学 来源: 题型:
A、 比较 Cl2、Fe3+、I2的氧化性 |
B、 制取Fe(OH)2 |
C、 证明铁生锈时空气参加反应 |
D、 检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HOCH2CH2COOH |
| B、HOOC-CH2CH(OH)CH2COOH |
| C、HOOC-COOH |
| D、HOCH2CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2O4和NO2的分子数比为1:2 |
| B、N2O4和NO2的浓度相等 |
| C、平衡体系的颜色一定不再改变 |
| D、单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8:12:5 |
| B、4:2:5 |
| C、4:6:5 |
| D、2:3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雾 |
| B、氢氧化铁胶体 |
| C、石灰乳 |
| D、KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
| H2 |
| 550℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
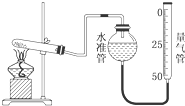 某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.
某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如图所示.部分实验步骤:①装好实验装置.②…③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为a g.④加热,开始反应,直到产生一定量的气体.⑤停止加热.⑥测量收集到的气体的体积.⑦准确称量试管和残留物的质量为b g.⑧测量实验室的温度.回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com