
【题目】下列说法不正确的是( )
A.天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B.无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
C.制玻璃和水泥都要用到石灰石原料
D.1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)第2周期的8种元素中,第一电离能介于①元素和③元素间的元素有__种。
(2)表中能形成两性氢氧化物的元素是___(填元素名称![]() ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
(3)②、⑤、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)___。
(4)④元素与⑩元素两者质子数之差是___。
(5)请写出③的气体氢化物发生催化氧化的化学方程式___。
(6)请写出⑥元素的最高价氧化物的水化物与⑧元素的最高价氧化物的水化物反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多有机化合物具有酸碱性。完成下列填空:
(1)a 苯酚 b 苯甲醇 c 苯甲酸 d 碳酸的酸性由强到弱的顺序为______________(填字母);
(2)欲将![]() 转化为
转化为![]() ,则应加入__________。
,则应加入__________。
(3)卤代烃可以与金属镁在无水乙醚作用下生成格氏试剂(RMgX,R为烃基),反应如下:RX+Mg ![]() RMgX,格氏试剂可以跟醛或酮的羰基发生加成反应,烃基加在羰基碳原子上,得到的镁盐水解后生成相应的醇:
RMgX,格氏试剂可以跟醛或酮的羰基发生加成反应,烃基加在羰基碳原子上,得到的镁盐水解后生成相应的醇:
![]()
① 某化合物A的分子式为C10H14O,它由下列合成路线制得:

A的结构简式为________,B的结构简式为________;
② 3-甲基-3-己醇可用该方法以CH3CH2CH2Cl和物质C为原料制得,C的键线式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是___。
(2)In的最高价氧化物的水化物的碱性___Ba(OH)2的碱性(填“>”或“<”)。
(3)![]() In的中子数与电子数的差值为___。
In的中子数与电子数的差值为___。
II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
C.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:___。
(5)A+、B2-、F3+离子半径由大到小的顺序为___(用离子符号表示)。
(6)电子式表示A2B的形成过程___。
(7)含F3+的溶液中通入过量D,反应的离子方程式是___。
(8)A单质与E反应的离子方程式为___,生成的化合物中化学键的类型是___。
III.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(9)Se原子结构示意图可表示为___。
(10)下列说法合理的是___。
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.热稳定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀工业会产生大量的电镀污水处理电镀污水时会产生大量的电镀污泥,电镀污泥含有多种金属(Ni、Cu、Fe、Cr、Al)的氢氧化物和不溶性杂质。下面是处理某种电镀污泥回收铜、镍元素的一种工业流程:

电镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度见下表。
![]()
(1)硫酸浸出过程中,为提高浸出速率,可以采取的措施有___________(写出两条)。
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe2+氧化,则磷酸盐沉淀中含有的物质为___________。
(3)假设电解前后Ni2+浓度基本不变,若使Ni2+在除杂过程不损失,则溶液中PO43-浓度不能超过________ mol/ L。(列出计算表达式.Ksp[Ni3(PO4)2]=5×10-31)
(4)滤液中的___________可回收循环使用;研究发现当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,滤液中出现铝元素的原因为________ (用离子方程式解释)。
(5)Ni(OH)2是镍氢蓄电池的正极材料,在碱性电解质中,电池充电时Ni(OH)2变为NiOOH,则电池放电时正极的电极反应式为________。
(6)电镀污水中的Cr元素也可以用铁氧体法处理,原理为在废水中加入过量的FeSO4,在酸性条件下Cr2O72-被还原为Cr3+,同时生成Fe3+;加入过量的强碱生成铁铬氧体(CrxFe3-xO4沉淀,写出加入过量强碱生成铁铬氧体(CrxFe3-xO4)沉淀的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
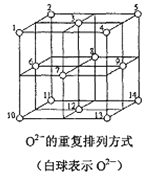
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
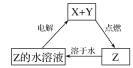
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如表
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3mol/(L·min)
B.其他条件不变,升高温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
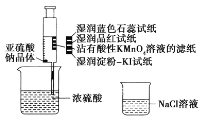
A. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
B. 蓝色石蕊试纸先变红后褪色
C. NaCl溶液可用于除去实验中多余的SO2
D. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com