


科目:高中化学 来源: 题型:
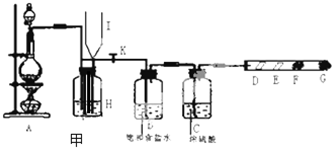
查看答案和解析>>
科目:高中化学 来源: 题型:
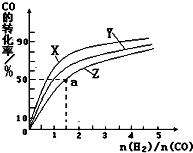 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
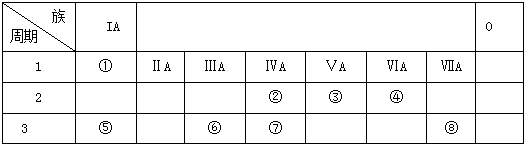
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准标况下,22.4L水所含的分子数目为6.02×1023个 |
| B、2g氢气所含氢原子数目为2×6.02×1023个 |
| C、500ml2mol?L-1的Ba(NO3)2溶液中含NO3-离子数为2×6.02×1023个 |
| D、0.5mol氯气分子中含Cl原子数为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、定容时仰视容量瓶瓶颈刻度线 |
| D、摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
B、右图能用作防倒吸装置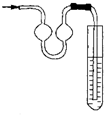 |
| C、蒸馏时,通过冷凝管冷凝得到的液体直接用锥形瓶接收 |
| D、称量NaOH固体时,应将砝码放在托盘天平右盘纸片上,NaOH固体放在左盘的纸片上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com