
��1����������(Na2FeO4)��ˮ���������е�һ�����;�ˮ�������������Աȸ�����ظ�ǿ�������ڷ�Ӧ�б���ԭ�����������Ӵﵽ��ˮ��Ŀ�ġ����������������������ƺ�������һ���������Ƶõģ�ͬʱ�����������ƺ��Ȼ��Ƶȡ�
��д����ȡ�������ƵĻ�ѧ����ʽ�� ��
������ȡ�������Ƶķ�Ӧ�� Ԫ�ر�������
�۸�������֮�����о�ˮ���ã���ɱ���⣬��һ��ԭ���� ��
��2����ij�����������У�Ҫ�õ�һ����ɫ��������ˮ�ľ�����立����þ�����һ�ָ��Σ�����Ҫ��ѧ�ɷ�Ϊʮ��ˮ��������李���ø��ε�Ũ��Һ����μ���Ũ����������Һ��������һϵ�б仯����֪��NH4+��AlO2����ˮ��Һ�в��ܴ������棬�ᷢ�����·�Ӧ��NH4++A1O2��+H2O=Al(OH)3��+ NH3��
�Իش�
�����������ˮ��Һ�еĵ��뷽��ʽΪ ��
������μ���Ũ����������Һ�Ĺ����У������������У�a��Һ�г��ְ�ɫ������b�д̼��������ݳ���c��ɫ�����������ࣻd��ɫ������ȫ��ʧ��e��ɫ�������١�
��ش�����������ȵ�����ֵ�˳����(����Żش�)�� ��
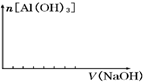
�۲�����ͼ�л����������Ƶļ��������������Ĺ�ϵ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| Ũ�ȣ�mol/L�� | a | 0.05 | 0.10 | 0.50 | 0.58 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

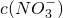 =______���������ڣ����ʲ������𣩣�
=______���������ڣ����ʲ������𣩣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
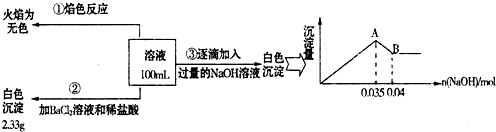
Ŀǰ��������(Na2FeO4)���㷺Ӧ����ˮ���������и�Ч�������ŵ㡣
(1)�ڴ���ˮ�Ĺ����У�Na2FeO4��ɱ������������ˮ�����ã���˵��Ӧ����Na2FeO4����Щ���ʣ�__________________________________________________________________________
(2) ij�غ�ˮ��Ʒ��Na2FeO4�������������Ӽ���Ũ�����±���ʾ(H����OH��δ�г�)��
| ���� | SO | Mg2�� | Fe3�� | Na�� | Cl�� |
| Ũ��(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
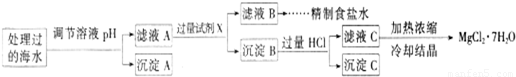
�����£�ȡһ������Na2FeO4�������ĺ�ˮΪԭ���Ʊ�����ʳ��ˮ��MgCl2��7H2O���������£�
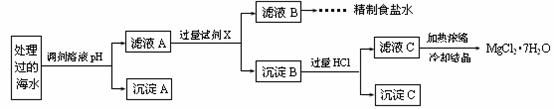
Ksp[Fe(OH)3]��1.0��10��38��Ksp[Mg(OH)2]��5.0��10��12��������������Һ����ı仯���Բ��ơ�
�� �����е�a________0.16(�<������>������)��
�� ����A�����Ϊ________(�ѧʽ)���ڵ�����ҺpHʱ��������Ӧ���ڵ�pH�ķ�Χ��________��
�� ����Ĺ����Լ�XΪ____________________(�ѧʽ)��
�� �������HCl������Ϊ_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ��Ϫһ�и������ϣ��������¿���ѧ�Ծ��������棩 ���ͣ������
| ���� | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| Ũ�ȣ�mol/L�� | a | 0.05 | 0.10 | 0.50 | 0.58 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com