
有0.1mol·L-1的三种溶液:①CH3COOH ②NaOH ③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
解析 溶液①中,根据电荷守恒有:c(H+)=c(CH3COO-)+c(OH-),则c(CH3COO-)<c(H+),A项错误;溶液①②等体积混合,得到0.05 mol/L的CH3COONa溶液,而③中CH3COONa溶液的浓度为0.1 mo l/L,故两溶液中c(CH3COO-)不相等,B项错误;溶液①②等体积混
l/L,故两溶液中c(CH3COO-)不相等,B项错误;溶液①②等体积混 合,得到0.05 mol/L的CH3COONa溶液,根据物料守恒有:c(CH3COO-)+c(CH3COOH)=c(Na+),C项正确;溶液①③等体积混合,混合液显酸性,CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),D项错误。
合,得到0.05 mol/L的CH3COONa溶液,根据物料守恒有:c(CH3COO-)+c(CH3COOH)=c(Na+),C项正确;溶液①③等体积混合,混合液显酸性,CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),D项错误。
答案 C


科目:高中化学 来源: 题型:
用1.0mol·L-1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
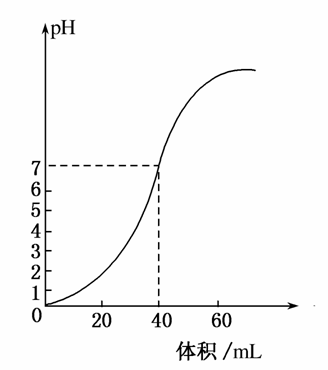
A.1mol·L-1,60mL
B.0.5mol·L-1,80mL
C.0.5mol·L-1,40mL
D.1mol·L-1,80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数。下列判断正确的是( )
A.25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
B.分别为7.8 g的Na2S和Na2O2中含有的 阴离子数分别是0.1NA和0.2NA
阴离子数分别是0.1NA和0.2NA
C.常温常压下,22.4 L CO2中含有的CO2分子数小于NA
D.1 L 0.1 mol/L的氨水含有0.1NA个NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
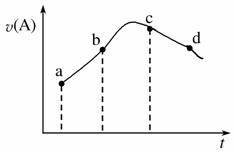
在恒温恒容的密闭容器中通入一定量的A、B,发生反应:A(g)+2B(g)3C(g)+D(l),下图是A的正反应速率v(A)随时间变化的示意图。下列说法正确的是( )
A.反应物A的浓度:a点小于b点
B.可能是某种生成物对反应起到催化作用
C.曲线上的c、d两点都表示达到反应限度
D.平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO 4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5 kJ·mol-1
③CO(g)1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线如图所示,结合各反应的ΔH,归纳lgK-T曲线变化规律:
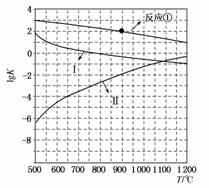
a)__________________________________________________________;
b)_________________________________________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5 mol·L-1,计算CO的转化率________(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________________________________________________________________________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为______________________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A===H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填选项字母),原因是________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)= 1.0×10-14
1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________(填选项字母)。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废
。为了使废 水的排放达标,进行如下处理:
水的排放达标,进行如下处理:
Cr2O
 Cr3+、Fe3+
Cr3+、Fe3+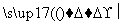 Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为___________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为______________。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO 、NO
、NO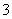 、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72 g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO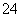 、NO
、NO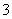
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化性:Br2>Fe3+>I2;还原性:I->Fe2+>Br-,则下列反应能发生的是( )
A.I2+2Fe2+===2Fe3++2I- B.2Br-+I2===Br2+2I-
C.2Fe3++2I-===2Fe2++I2 D.2Fe3++2Br-===2Fe2++Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com