
����Ŀ��Ԫ��X��Y��Z��M��N��Ϊ����������Ԫ�أ���ԭ����������������֪Yԭ������������������������֮��Ϊ3��4��Mԭ�ӵ���������������������֮��Ϊ3��4��N����Arԭ�ӵ��Ӳ�ṹ��ͬ��X�Ƕ���������Ԫ����ԭ�Ӱ뾶��С�ģ�Z�Ƕ���������Ԫ����ԭ�Ӱ뾶���ģ�������XN������Ϊ���壮�ݴ˻ش�
��1��N������������Ӧˮ����Ļ�ѧʽ�� ��
��2��Z��M�γɵĻ�����ˮ��Һ�Լ��ԣ���ԭ�����������ӷ���ʽ��ʾ����
��3��X��Y��X��M�����γ�18���ӷ��ӣ������ַ�����ˮ��Һ�з�Ӧ�ɹ۲쵽�������� �� ��Ӧ�Ļ�ѧ����ʽ�� ��
��4����X��Y��Z��M����Ԫ�����һ��ǿ�����ʽ�Σ�д��Ba��OH��2��Һ����μ��������Һ�����Ե����ӷ���ʽ ��
��5��Y��Z��N�γɵĻ������ˮ��Һ������Ũ�ȵĴ�С˳���� ��
��6����ͼ��ʾ�� 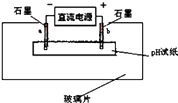
ȡһ����ZN��Һ��ʪ��pH��ֽƽ���ڲ���Ƭ�ϣ�ȡ����ʯī�����缫����ֱͨ����Դ��һ��ʱ���a�缫����pH��ֽ�Ͽɹ۲쵽�������� ��
���𰸡�
��1��HClO4
��2��S2��+H2O?HS��+OH��
��3����ɫ��Һ�в�������ɫ������H2O2+H2S=S��+2H2O
��4��Ba2++2OH��+2H++SO42��=BaSO4��+2H2O
��5��c��Na+����c��ClO������c��OH������c��H+��
��6����ֽ�ȱ����������ɫ�����������Ư����ɫ
���������⣺Yԭ������������������������֮��Ϊ3��4�������������������ܳ���8������Y������������ֻ����6��ԭ������Ϊ8����Y��O��Mԭ�ӵ����������������������֮����3��4��������Ԫ�صĴ���������һ����2��8������M��ԭ������Ӧ����16����M��S��X�Ƕ�����Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���X��H��Z�Ƕ�����Ԫ����ԭ�Ӱ뾶����Ԫ�أ���Z��Na��N��ԭ�������������X�γɵĻ�����XN�����������壬��N����Arԭ�ӵ��Ӳ�ṹ��ͬ������N��Cl����1���ȵ�����������ˮ����Ļ�ѧʽ�� HClO4 �� ���Դ��ǣ�HClO4����2��ZΪ�ƣ�MΪS��Z��M�γɵĻ�����Ϊ���ƣ�Ϊǿ�������Σ�ˮ��ʼ��ԣ����ӷ���ʽΪS2��+H2OHS��+OH�� �� ���Դ��ǣ�S2��+H2OHS��+OH������3��X��Y�γɵ�18���ӻ�����ΪH2O2 �� X��M�γɵ�18���ӻ�����ΪH2S�����߷�Ӧ�������ʵ���ɫ����������H2O2+H2S=S��+2H2O�����Դ��ǣ���ɫ��Һ�в�������ɫ������H2O2+H2S=S��+2H2O����4��Y��Z��N�γɵĻ�����Ϊ�������ƣ���Ba��OH��2��Һ����μ�������������Һ�����ԣ����߰�1��2��Ӧ�������ᱵ�������ơ�ˮ���������ʵ���Ϊ1��1��2����Ӧ�����ӷ���ʽΪ��Ba2++2OH��+2H++SO42��=BaSO4��+2H2O�����Դ��ǣ�Ba2++2OH��+2H++SO42��=BaSO4��+2H2O����5��Y��Z��N�γɵĻ�����ΪNaClO��Ϊǿ�������Σ�ˮ��ʼ��ԣ���Һ�д���c��Na+����c��ClO������c��OH������c��H+�������Դ��ǣ�c��Na+����c��ClO������c��OH������c��H+������6������Ȼ�����Һ��aΪ����������2H2O+2 e��=H2��+2OH�� �� ��Һ�ʼ��ԣ�pH����ɫ�����ŵ��Ľ��У���ɫ��Χ������������������������ˮ��Ӧ���ɾ���Ư���Ե�HClO����ʹ��ֽƯ����ɫ�����Դ��ǣ���ֽ�ȱ����������ɫ�����������Ư����ɫ��


 ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ��Ũ���ᷴӦ��������ƿ��ͭƬδ��ȫ�ܽ⡣����Ӧ�����Һ�м����������ʣ�����ƶϴ�����ǣ� ��
A.�������ۣ������ܽ�B.����NaNO3��Һ��ͭƬ���ܽ�
C.�������ۣ����۲��ܽ�D.����NaHCO3��Һ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ����Ԫ���γɵ�ͬһ���ͻ����������ṹ���������ƣ�PH4I��һ�ְ�ɫ���壬���ж�PH4I�������У���ȷ���ǣ� ��
A.����һ�ֹ��ۻ�����
B.���Ⱥ����Ӽ��ֺ����ۼ�
C.����������NaOH��Һ��Ӧ
D.������ʱ�����ֽܷ������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ��������ˮ��Һʱ���Ӳ���۲쵽һ����������ͨ·����˵��������ˮ��Һ��( )
A. ���� B. ��Һ C. ����Һ D. ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ���������ԭ������������������ֶ�����Ԫ�أ�A��B��C��D��E�������е����ֻ�����Ԫ����ɵĻ����F���ɱ�Ԫ���γɵĵ��ʣ���֪��A+B=D+F��A+C=E+F�� 0.1 molL��1D��Һ��pHΪ13��25�棩������˵����ȷ���ǣ� ��
A.ԭ�Ӱ뾶�����������ң���
B.��Ԫ�������ڱ��е�λ��Ϊ�������ڵڢ�A��
C.1 molA������B��ȫ��Ӧ��ת����1 mol����
D.1.0 L 0.1 molL��1E��Һ���������ܵ����ʵ���С��0.1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��ʹʪ��ĵ��۵⻯����ֽ����ɫ�����岻һ��������
B. ��˿����������ȼ�գ��������ڿ�����ȼ��
C. �������������������������������ǵ�ˮ��Һ����ǿ��
D. Һ��Ӧ������ĥ�ڲ������Լ�ƿ�У���������ˮ����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ص�����������Ӧ��ˮ����������ǿ����
A.ԭ�ӵ�L���Ӳ�p���ֻ�����������ӵ�Ԫ��
B.��Χ�����Ų�ʽΪ3s23p2��Ԫ��
C.����������7���۵��ӵ�Ԫ��
D.3p������Ӱ������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ������ ��
A. 18gD2O��18gH2O�к��е���������Ϊ10NA
B. 2L0.5mol/L��������Һ�к��е�H+������Ϊ2NA
C. ����������ˮ��Ӧʱ������0.1mol����ת�Ƶĵ�����Ϊ0.2NA
D. �ܱ�������2molNO��1molO2��ַ�Ӧ������ķ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڵ��Լ���ȥ���������е��������ʣ���ȷ���ǣ� ��
A.�屽�е��壨KI��Һ��
B.�Ҵ��е����ᣨNaOH��Һ��
C.���е����ͣ�Br2ˮ��
D.���������е����ᣨ����Na2CO3��Һ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com