
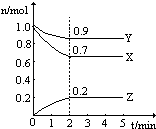
 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:| △c |
| △t |
| ||
| 2min |
| 0.022 |
| 0.073×0.09 |
(
| ||||
(
|


科目:高中化学 来源: 题型:
| A、HClO H2CO3 CH3COOH |
| B、HClO4 HClO3 HClO2 |
| C、HClO4 H2SO4 H3PO4 |
| D、HClO4 HBrO4 HIO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
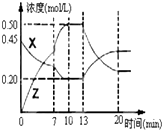 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
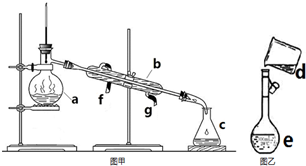 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是
如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是| A、试纸A端发生还原反应 |
| B、Ag+从银电极移向石墨,K+移向A端 |
| C、试纸B端出现棕色 |
| D、石墨上电极反应式:I2+2e-=2I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com