
某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.用食醋除去水壶内的水垢:CaCO3+2H+===Ca2++CO2↑+H2O
B.用惰性电极电解饱和氯化镁溶液:
2Cl-+2H2O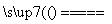 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.少量Cl2通入FeBr2溶液中:2Br-+Cl2===2Cl-+Br2
D.过量NaHSO4溶液加入到Ba(OH)2溶液中:
2H++SO +Ba2++2OH-===2H2O+BaSO4↓
+Ba2++2OH-===2H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铜是人们最早使用的金属之一,下列关于铜电极的叙述不正确的是( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜做阳极
C.在镀件上镀铜时可用金属铜做阳极
D.电解水制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)===C(金刚石) ΔH=1.9 kJ·mol-1可知,金刚石比石墨稳定
D.在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为__________________________________________;
③电极b上生成的气体在标准状况下的体积为________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液________________;乙溶液________________;
丙溶液________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施不合理的是( )
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洁锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
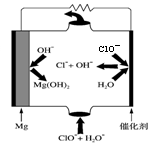
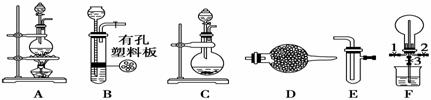
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入______________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子____________________________________。
Ⅱ.探究某些物质的性质
(3)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________。
(4)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式___________________________________________________________。
(5)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为__________________________________________;
F中的烧杯所起的作用是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com