
| A. | 标准状况下,0.56L丙烷中含有共价键的数目为2.5NA | |
| B. | 常温常压下,6.4g氧气和臭氧的混合气体中含有的原子总数为0.4NA | |
| C. | 5.6g铁与一定量浓硫酸恰好反应,转移的电子数目可能为0.2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
分析 A.根据标况下丙烷的体积计算出丙烷的物质的量,再计算出含有的共价键数目;
B.根据氧气和臭氧中含有的氧原子的质量计算出氧原子的物质的量及数目;
C.根据常温下铁与浓硫酸发生钝化判断;
D.pH=12的Na2CO3溶液中c(H+)=10-12mol/L,根据水的离子积计算溶液中c(OH-),再根据n=cV计算n(OH-),根据N=nNA计算OH-离子数目.
解答 解:A.标况下,0.56L丙烷的物质的量为0.025mol,含有0.05mol碳碳共价键和0.4mol碳氢共价键,总共0.45mol共价键,含有共价键数为0.45NA,故A错误;
B.3.2g臭氧和氧气的混合物中含有6.4g氧原子,含有0.4mol氧原子,混合气体中含有的原子数为0.4NA,故B正确;
C.在常温下铁与浓硫酸发生了钝化现象,阻止了反应的进行,故C正确;
D.pH=12的Na2CO3溶液中c(H+)=10-12mol/L,故溶液中c(OH-)=$\frac{10{\;}^{-14}}{10{\;}^{-12}}$=0.01mol/L,溶液中n(OH-)=20L×0.01mol/L=0.2mol,OH-离子数目为0.2mol×NAmol-1=0.2NA,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数,难度不大,注意质量守恒定律和电子守恒的应用,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等间的转化关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
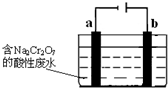 工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨):
工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去.如图为电解装置示意图(电极材料分别为铁和石墨):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L N2和O2的混合气体中含有的分子数为NA | |
| B. | 常温常压下,11.2 L二氧化硫中所含的氧原子数等于NA | |
| C. | 标准状况下,80 g SO3中含3NA个氧原子,体积约为22.4 L | |
| D. | 足量Zn与一定量的浓硫酸反应,产生22.4 L气体时,转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O | |
| B. | 稀盐酸除铁锈:6H++Fe2O3=2Fe3++3H2O | |
| C. | 金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | Na2O2和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都易溶于水,相同温度下,碳酸钠的溶解度大于碳酸氢钠 | |
| B. | 水溶液都呈碱性,相同物质的量浓度时,碳酸钠溶液的pH大于碳酸氢钠溶液 | |
| C. | 碳酸钠的稳定性比碳酸氢钠强,碳酸氢钠受热易分解 | |
| D. | 碳酸钠与碳酸氢钠溶液可以用澄清石灰水鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com