
分析 (1)过氧化氢是共价化合物,依据过氧化氢结构分析,氧原子和氧原子,氧原子和氢原子分别形成非极性键、极性键;
(2)过氧化氢分子间,氧原子和氢原子间易形成氢键;
(3)稀硫酸与Ba02反应来生成H2 O2和硫酸钡沉淀;
(4)根据碳酸酸性大于H2O2,Na2O2与干燥的CO2不反应,知应是水和CO2生成碳酸,依据强酸制弱酸的原理,碳酸再与Na2O2反应生成H2O2;H2O2不稳定,发生了分解.;
(5)高锰酸钾酸性溶液氧化过氧化氢为氧气,高锰酸根离子被还原为锰离子,结合反应的定量关系计算元过氧化氢的浓度.
解答 解:(1)过氧化氢是共价化合物,依据过氧化氢结构分析,氧原子和氧原子间形成非极性键,氧原子和氢原子间形成极性键,
故答案为:非极性键、极性键;
(2)过氧化氢分子间,氧原子和氢原子间易形成氢键,H2O2能与水任意比混合,且纯净的H2O2具有较高的沸点,
故答案为:氢键;
(3)稀硫酸与Ba02反应来生成H2O2和硫酸钡沉淀,反应的化学方程式为:H2SO4+BaO2=BaSO4↓+H2O2,
故答案为:H2SO4+BaO2=BaSO4↓+H2O2;
(4)经测定H2O2为二元弱酸,酸性比碳酸还弱,不稳定易分解.已知Na2O2中通人干燥的C02不反应,但通人潮湿的CO2却可以产生O2,是水和CO2生成碳酸,依据强酸制弱酸的原理,碳酸再与Na2O2反应生成H2O2;H2O2不稳定,发生了分解生成氧气,反应的化学方程式为:Na2O2+CO2+H2O=Na2CO3+H2O2 2H2O2=2H2O+O2↑,
故答案为:Na2O2+CO2+H2O=Na2CO3+H2O2 2H2O2=2H2O+O2↑;
(5)高锰酸钾酸性溶液氧化过氧化氢为氧气,高锰酸根离子被还原为锰离子,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,用移液管吸取10.00mL的H2O2样品,置于100ml)容量瓶中,加水稀释至刻度线,取25.OOmL溶液置于锥形瓶再加入lOmL 3mol/L的稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00ml,
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
2 5
0.02×0.02mol n(H2O2)
n(H2O2)=0.001mol
100ml溶液中含过氧化氢物质的量=$\frac{100}{25}$×0.001mol=0.004mol
原H2O2溶液的浓度=$\frac{0.004mol×34g/mol}{0.01L}$=13.6g/mol,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;13.6.
点评 本题考查了过氧化氢结构、性质的分析应用,溶液浓度的测定方法,注意过氧化氢性质的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 它是高分子化合物 | |
| B. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| C. | 在一定条件下能水解最终生成多肽 | |
| D. | 氨基酸和蛋白质Shp-2都只能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
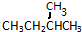
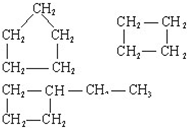 E.
E.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| D. | CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=+736kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
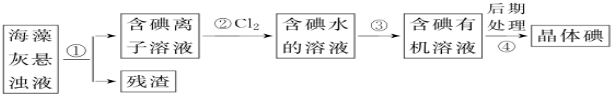
| A. | 步骤①、③的操作分别是过滤、萃取 | |
| B. | 可用硝酸银溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是裂化汽油或四氯化碳 | |
| D. | 步骤④的操作是过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g甲基(-14CH3)所含的中子数为8NA | |
| B. | 0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 L O2混合后气体的分子总数为2NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
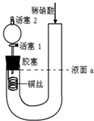 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )
为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )| A. | 在装置左侧稍加热可以加快稀硝酸与铜的反应速率 | |
| B. | 关闭活塞1,加入稀硝酸至液面a处 | |
| C. | 通过关闭或开启活塞1可以控制反应的进行 | |
| D. | 反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、CO32-、Br- | B. | Fe2+、H+、NO3-、Cl- | ||
| C. | Al3+、Ca2+、HCO3-、SO42- | D. | Fe3+、Cu2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池总反应为:4NH3+3O2═2N2+6H2O | |
| B. | a极的电极反应为:2NH3-6e-═N2+6H+ | |
| C. | b极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| D. | a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com